Das Periodensystem wird 150! Oder gar schon 203?
| 16. Dezember 2019
In seinem Gastbeitrag für das Dossier "Mein Element" wirft Peter Unfried einen Blick in die Entstehungsgeschichte des Periodensystems und erklärt, warum wir heuer eigentlich auch dessen 203. Jubiläum feiern könnten. (© Daniel Spreitzer)
2019 feiert die Welt 150 Jahre Periodensystem. Aber ist dieser "Chemie-Baukasten", den wir in der Schule auswendig lernen mussten, nicht längst veraltet? Chemiker Peter Unfried von der Uni Wien erklärt, warum das Periodensystem nach wie vor unverzichtbar ist – und vielleicht älter als gedacht.
Es erscheint wohl vielen als übertrieben und altmodisch, der Entdeckung des Periodensystems gleich ein ganzes Jahr zu widmen. Denn schließlich wissen wir heute ungemein mehr über den Aufbau der Materie und die Anordnung der Atome, Moleküle und Atomkerne bis hin zu deren Protonen, Neutronen, Elektronen und Orbitalen als noch vor 150 Jahren.
Und doch ist seine Bedeutung ungebrochen: für Lehrerinnen und Lehrer als didaktisches Werkzeug, aber auch für Forscherinnen und Forscher als Vermittler zwischen "Wunsch und Wirklichkeit".
Ausstellungs-Tipp:
Besuchen Sie eine der beiden von Peter Unfried initiierten und kuratierten Erlebnisausstellungen im Wirtschaftsmuseum, die leicht verständlich anorganisch-chemische Zusammenhänge präsentieren: "Auer von Welsbach" und "Die Schönheit der Elemente".
2.500 Jahre Elemente-Forschung im Schnelldurchlauf
Der Naturforscher Empedokles definierte im Jahr 450 v. Chr., dass die Materie aus den vier Urelementen Erde, Wasser, Luft und Feuer zusammengesetzt sei. Erst 2.000 Jahre später wurde eine Abkehr von dieser Vier-Elemente-Lehre gewagt: Der britische Naturforscher Robert Boyle postulierte 1661 die Existenz von Atomen. Um 1700 ging der Alchemist Ernst Stahl noch einen Schritt weiter: Jeder Stoff enthalte mehr oder weniger der hypothetischen Substanz "Phlogiston", die bei der Verbrennung entweiche.
Rund 100 Jahre später präsentierte Antoine Lavoisier, ein französischer Chemiker, seine "Oxidationstheorie" als Gegenpol zur "Phlogiston-Theorie" (bei jeder Verbrennung vereinigt sich Materie mit "Oxygenium"), sowie den Beweis, dass Wasser kein Element, sondern zusammengesetzt sei.
Es folgte 1800 der englische "Wegbereiter der Chemie" John Dalton mit seiner Annahme, dass jedes Element aus gleichartigen "Atomen" bestünde, die sich nach festen Regeln zu "Molekülen" verbinden würden.

John Daltons definierte erstmals den Begriff "Atomgewicht". Damit war die Grundlage für eine gewisse Systematik der bis dahin bekannten 33 Elemente geschaffen. Im Bild seine "Atomgewichts-Tabelle" (© Wikimedia Commons)
Die Elemente "aufräumen"
Als nächstes versuchten die fähigsten Chemiker dieser Zeit, eine Ordnung in die damals bekannten "Chemischen Elemente" zu bringen: Den Anfang machte J. W. Döbereiner. Er entdeckte 1816 – also schon vor 203 Jahren – die chemische Ähnlichkeit von Calcium (Ca), Strontium (Sr) und Barium (Ba) und nannte diese "Triade". Damit schuf er einen Vorläufer der heute bekannten "Gruppen" im Periodensystem – eine derart wichtige Entdeckung, dass man sie quasi als Geburtsstunde des "Periodischen Systems der Elemente" sehen könnte.
Etwas später ordnete Döbereiner bereits 30 der damals 53 bekannten Elemente in Triaden an. Er sagte mittels seiner Triaden-Regel sogar das Atomgewicht von Brom voraus, das sich daraufhin in die Triade "Chlor (Cl)-Brom (Br)-Jod (J)" einfügte.
Das erste "echte" Periodensystem – und ein Prioritätenstreit
Der englische Chemiker John A.R. Newlands entdeckte und beschrieb 1864 erstmals die "8er-Periodizität" der chemischen Eigenschaften: Ordnet man die Elemente nach ihrem Atomgewicht, so wiederholen sich gewisse physikalische und chemische Eigenschaften wie Wertigkeit, Reaktivität mit Wasser, Basizität der Oxide, Flüchtigkeit usw. im "Achter-Rhythmus" (die Edelgase waren zu dieser Zeit noch nicht bekannt).
Ebenfalls 1864 – damit also bereits vor 155 Jahren – veröffentlichte Lothar Meyer, deutscher Arzt und Chemiker, das erste "echte" Periodensystem, das dem heutigen schon sehr nah kam. Er sah seine Anordnung überdies darin bestätigt, daß die Differenz untereinander gereihter Elemente in einer Periode (von links nach rechts) nahezu konstant blieb.
Die wirklich sensationelle Leistung des Russen Dimitri Mendelejew – der neben Meyer als einer der Entdecker des Periodensystems gefeiert wird – bestand darin, dass er 1871 auf Grund der damaligen Kenntnisse des bereits vorhandenen Periodensystems wagemutig erstmals Existenz und Eigenschaften noch unentdeckter Elemente vorhersagte: "Eka-Aluminium" , "Eka-Bor" und "Eka-Silizium" – heute bekannt als Gallium (Ga), Scandium (Sc) und Germanium (Ge).

1869, nur fünf Jahre nachdem Meyer sein Periodensystem (siehe oben) vorstellte, wurde die Version von Mendelejew (siehe unten) publiziert – und sie glich dem Meyer'schen frappant. Diese Tatsache mündete in einem unglaublichen Prioritätenstreit, der sich über viele Jahre dahinzog. (© Wikimedia Commons)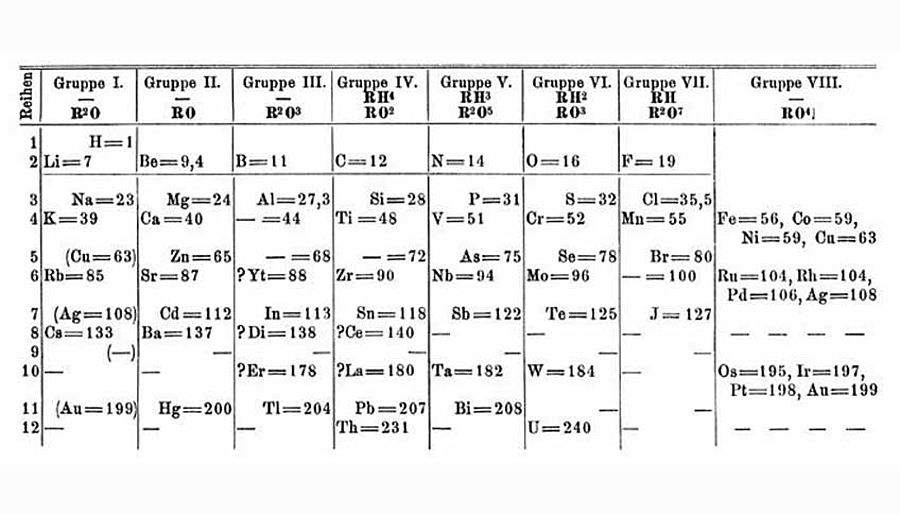
Entdeckungen im 20. Jahrhundert
Aber! Zu Mendelejews Zeit waren noch keine Protonen und Elektronen bekannt, kein Atommodell mit Kern, keine Elektronenschalen mit Orbitalen und keine Radioaktivität. Erst 40 Jahre später (1911) konnte Ernest Rutherford in Neuseeland mittels Streuversuchen von Alpha-Teilchen an Goldfolie nachweisen, dass die "Masse" im positiven Kern konzentriert ist und die viel kleineren Elektronen diesen als "Schale" umgeben. Als Henry Moseley 1913 mittels Röntgenstrahlung eine systematische Beziehung zwischen Wellenlänge und Ordnungszahl herstellte ("Moseley'sches Gesetz" ), konnte man diese Entwicklung mit Recht als abgeschlossen bezeichen.
Wussten Sie dass …
… zuletzt im Jahr 2006 die Erzeugung des "neuesten" Elements 118 (Oganesson) bekannt gegeben wurde? Es entstand durch Beschuss von Californium mit Calcium-Ionen. Über seine chemischen Eigenschaften gibt es bisher keine experimentellen Befunde, da das Element nur indirekt anhand seiner Zerfallsprodukte nachgewiesen wurde. Weitere Infos zu Oganesson (Wikipedia)
"Nicht erfunden, sondern gefunden"
Welche Bedeutung hat nun das Periodensystem der Elemente für uns heute? Es wurde ja nicht erfunden. Es wurde vielmehr gefunden, entdeckt! Nicht die Reihung nach dem Atomgewicht (mit wenigen Ausnahmen) ist das Sensationelle an dem System, sondern die Erkenntnis der Periodizität der chemischen und physikalischen Eigenschaften: Die Gruppen sind nicht willkürlich oder künstlich angelegt, sondern deren Elemente kommen genau so in der Natur vergesellschaftet vor (Gesteine, Erze, Minerale). Die gefundene Ordnung der Haupt- und Nebengruppen, Lanthaniden und Actiniden, ergibt sich zwangläufig aus den naturgegebenen Elektronenkonfigurationen der Elemente.
Gleichzeitig zeigte das Periodensystem damals genau auf, dass es noch weiße Flecken gibt, die es zu füllen gilt – ein Ansporn für die chemische Fachwelt weitere Elemente zu entdecken (Gallium, Germanium, Scandium, Seltene Erden usw.).
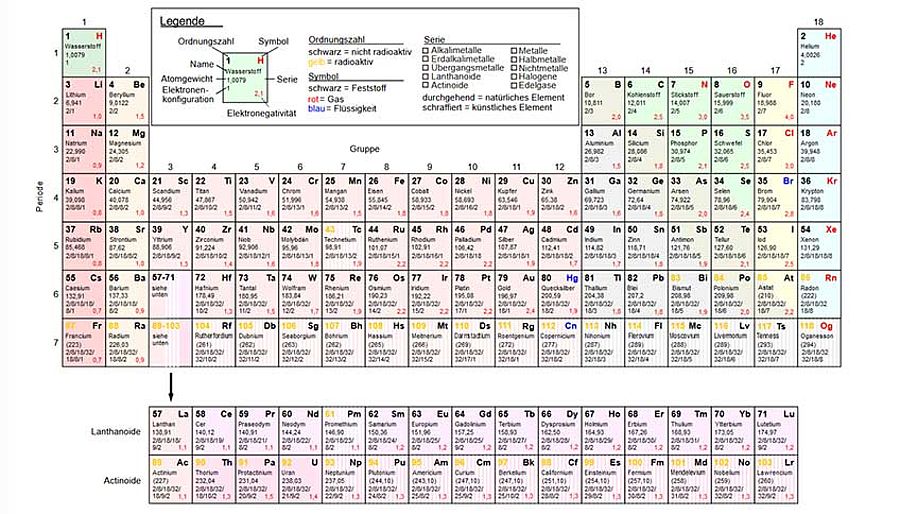
Genial: Das Periodensystem (im Bild in seiner heutigen Form) wurde ausschließlich anhand der chemischen Ähnlichkeiten von Elementen gefunden – und das, obwohl es seinerzeit noch kein Wissen über Atomkerne, Protonen, Neutronen, die Elektronen und deren Orbitale etc. – also die eigentlichen Ursachen dieser natürlichen Ordnung – gab. (© Wikimedia Commons)
Enorme Bedeutung für die heutige Zeit
In didaktischer Hinsicht ist das Periodensystem der Elemente das mächtigste Werkzeug, das Lehrkräften in die Hand gegeben wurde, um Schülerinnen und Schülern chemische Zusammenhänge zu vermitteln. Die Forscherinnen und Forscher, die z.B. erstmals mit dem Element Hafnium (Hf) zu tun haben, können ohne Probleme aus dem System herauslesen, dass es sich ähnlich dem wohlbekannten Zirkon (Zr) derselben Gruppe verhält und ihre Forschungsstrategie entsprechend anlegen.
Sowohl für die Synthese neuer chemischer Verbindungen (z.B. Entwicklung tumorhemmender Wirkstoffe) als auch in der Technik (z.B. chemische Katalyse), ist das Periodensystem als Vermittler dessen, was Forscherinnen und Forscher wollen, und dessen, was die Natur ihnen vorgibt, nach wie vor unerlässlich!

Peter Unfried ist Assistenzprofessor am Institut für Anorganische Chemie der Universität Wien. Er forscht zu Elementen der Seltenen Erden und Möglichkeiten zur Auftrennung und Feinreinigung von Selten-Erd-Gemischen im "Technikums-Maßstab" (kg-Maßstab).
Sein Lieblingselement ist Erbium, das zu den Metallen der Seltenen Erden zählt (Ordnungszahl: 68; Symbol: Er; Gruppe: Lanthanoide; Masse gerundet: 167,26, Vorkommen: natürlich).
Der Dezember steht im uni:view Magazin ganz im Zeichen der Elemente: Im Dossier "Mein Element" präsentieren WissenschafterInnen Überraschendes und Wissenswertes zu Elementen, mit denen sie in Forschung und Lehre arbeiten.



