"Wirkstoffe sind immer ein Kompromiss"
| 07. Oktober 2020Zum Einstieg in unsere Semesterfrage 2020/21 "Welche Wirkstoffe haben Zukunft?" erklärt Gerhard Ecker, Dekan der Fakultät für Lebenswissenschaften, was Wirkstoffe überhaupt sind, wo sie im menschlichen Körper wirken und wie man sie findet.
Zunächst ein kleiner Leitfaden durch den Begriffe-Dschungel: Ein Wirkstoff ist eine aktive Substanz, die in einem Organismus eine bestimme Reaktion hervorruft – mit dem Ziel, eine Krankheit zu beeinflussen. In der Wissenschaftssprache verwendet man dafür den Begriff "Drug", in der Pharmazie ist auch von Arzneistoffen die Rede. Damit ein solcher Stoff die gewünschte Wirkung entfalten kann, braucht er im Körper ein Zielmolekül, an das er andocken kann. Der englische Fachbegriff für dieses Ziel lautet "Target" oder "Drug Target".
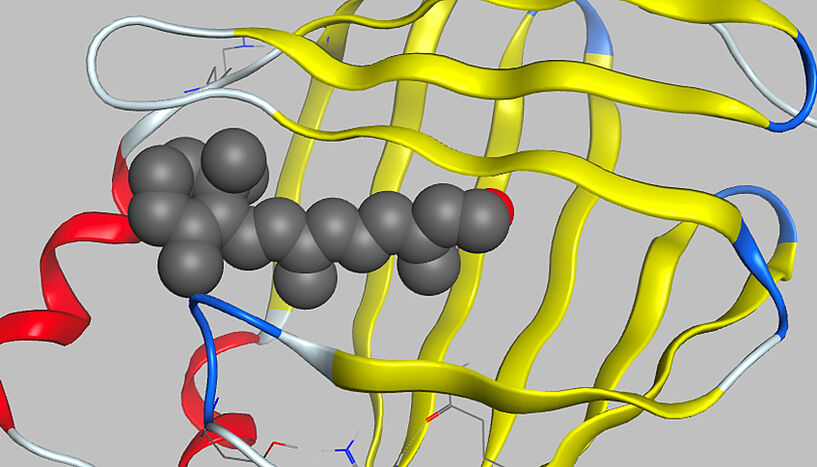
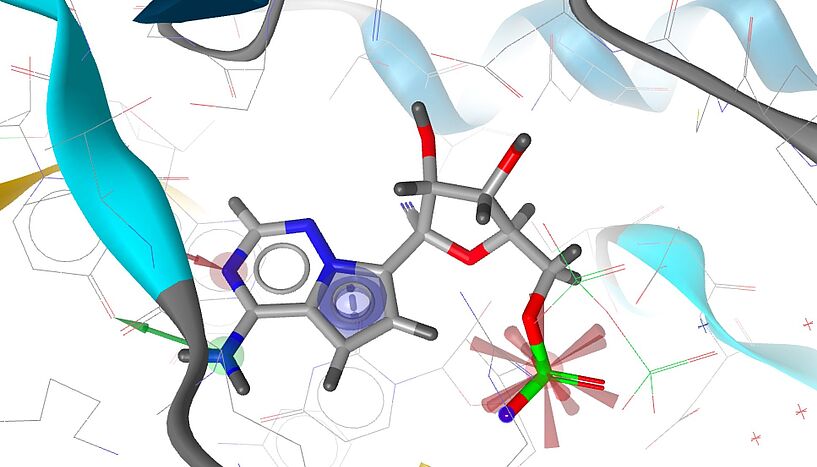
"Die meisten Targets sind Proteine – zum Beispiel Enzyme, Rezeptoren oder Transporter", erklärt Gerhard Ecker, Dekan der Fakultät für Lebenswissenschaften. Um die Funktionsweise dieser Targets zu erklären, verwendet man in der Lehre häufig das Bild von Schlüssel und Schloss. Das Targetmolekül ist in diesem Schema das Schloss, der Wirkstoff der Schlüssel. "Je besser und genauer der Schlüssel ins Schloss passt, desto höher ist die Aktivität auf molekularer Ebene", so Ecker, der an der Uni Wien die Pharmacoinformatics Research Group leitet.
Die Universität Wien trägt wesentlich zur Forschung und Lehre auf dem Gebiet neuer Wirkstoffe bei. So ist sie (unter der Leitung von Thierry Langer vom Department für Pharmazeutische Chemie) am EU-IMI Projekt NeuroDeRisk beteiligt, bei dem es darum geht, in der Entwicklung neuer Medikamente das Risiko von toxischen Effekten auf das Nervensystem zu minimieren. Unter der Leitung von Gerhard Ecker ist die Uni Wien außerdem Teil von drei weiteren IMI Projekten: eTRANSAFE, EUTOXRISK und RESOLUTE. IMI, die EU Innovative Medicines Initiative, ist eine groß angelegte Public Private Partnership zwischen Europäischen Institutionen und der Pharmazeutischen Industrie.
Im Umkehrschluss heißt das: Je ungenauer Schlüssel in molekulare Schlösser passen (wie es in der realen Welt etwa Generalschlüssel tun), desto mehr potenziellen Schaden können sie anrichten – Stichwort Nebenwirkungen. Das Ziel der modernen Arzneistoffentwicklung ist daher, möglichst präzise Wirkstoffe für jene Zielmoleküle zu finden, die ursächlich für eine Krankheit verantwortlich sind oder die Symptome der Krankheit lindern können.
Wie wirkt ein Wirkstoff?
Doch wie wirken Drugs auf Targets ein? In der Regel lagern sich die Wirkstoffmoleküle an die Targetmoleküle an und hindern sie so am Funktionieren. So werden Prozesse wie etwa die unkontrollierte, übermäßige Teilung von Zellen ausgeschaltet – dies ist der grundlegende Wirkmechanismus von Tumortherapeutika. Ein anderes Beispiel: Verhindert man den Einstrom von Ionen in Nervenzellen, kann die Erregungsweiterleitung verhindert werden. Auf diesem Prinzip basieren Lokalanästhetika beim Zahnarzt oder auch Arzneistoffe gegen Herzrhythmusstörungen.
In manchen Fällen wird das Target auch durch den Wirkstoff aktiviert – zum Beispiel bei den sogenannten Triptanen, die durch Aktivierung von Serotoninrezeptoren im Gehirn zu einer Verengung der Blutgefäße führen und somit einen Migräneanfall mildern.
"Die Forschung wird sich auf Wirkstoffe konzentrieren, die Volkskrankheiten wie Krebs oder Demenz besser behandelbar machen. Vielleicht wird es möglich sein, zumindest einen Teil der Krebserkrankungen durch einen Cocktail an Substanzen zu einer chronischen Krankheit zu machen – ähnlich wie bei HIV. Ein großes Thema sind aber auch die tausenden seltenen Erkrankungen, die oft nur sehr wenige Patient*innen betreffen", antwortet Gerhard Ecker auf die Semesterfrage "Welche Wirkstoffe haben Zukunft?". Diskutieren Sie darüber auch im Forum+.
Von der Krankheit bis zum Arzneistoff
Der Weg von der Krankheit bis zum zugelassenen Arzneistoff ist lang und aufwendig, wie Gerhard Ecker erklärt: "Dazwischen liegen mindestens zehn Jahre, mehrere Milliarden Euro und zehntausende Substanzen, die getestet werden."
Am Beginn steht ein Krankheitsbild, das entweder noch nicht oder nicht gut genug mit Medikamenten behandelt werden kann. "Der erste, sehr schwierige Schritt ist, das Target – das 'Schloss' – im Körper zu finden", so Ecker. Auf diese Suche begeben sich meist interdisziplinäre Teams, etwa aus der molekularen Pharmakologie, der Biologie und der Pharmazie. Manchmal zeigen auch breit angelegte genetische Studien Mutationen auf, die Erkrankungen auslösen.
Ist das Target gefunden, beginnt die Suche nach möglichen Wirkstoffen. Dies kann einerseits über breite Testverfahren passieren: Pharmaunternehmen können Hundertausende oder sogar Millionen von Substanzen, die sie in sogenannten Substanzbibliotheken aufbewahren, testen, um herauszufinden, welche davon sich an das Target binden. Üblicherweise greift man ergänzend auf computerunterstützte Verfahren zurück, wie sie auch an der Universität Wien entwickelt werden: Gibt es etwa schon ein 3D-Modell vom Targetmolekül, können die Forscher*innen vorab einschränken, welche Substanzen potenziell in Frage kommen, und nur mehr diese tatsächlich testen.
"From hit to lead"
Sind die ersten "Treffer", auch "Hits" genannt", gefunden, geht es weiter in die Feinarbeit. Gerhard Ecker: "In dieser Phase werden Substanzen synthetisiert, die Chemiker*innen experimentieren mit der Basisstruktur der Stoffe und probieren verschiedene Modifikationen aus." Das Motto dieser Entwicklungsphase ist "from hit to lead": Am Ende sollten einige Substanzen gefunden sein, die in die Multi-Parameter-Optimierung gehen. "Ein Wirkstoff ist auch immer ein Kompromiss – und zwar aus Faktoren wie Wirkung, Wirkungsdauer, Nebenwirkungen etc.", erklärt Gerhard Ecker.
Besonders vielversprechende Verbindungen werden in ersten Tierversuchen getestet, um erste Daten zur Toxizität (Giftigkeit) der Substanz zu erhalten. Erst nach diesen umfangreichen vorklinischen Tests geht ein Wirkstoff in die drei Phasen der klinischen Studien: Erprobung mit wenigen gesunden Proband*innen, Erprobung mit wenigen kranken Proband*innen, Erprobung mit vielen kranken Proband*innen. Am Ende steht die Zulassung eines Medikaments bei der zuständigen Behörde – in der EU ist das die EMA (European Medicines Agency). (bw)
Welche Fragen haben Sie zum Thema Wirkstoffe? Im Forum+ auf derstandard.at können Sie posten und diskutieren, was Sie im Zuge der Semesterfrage besonders interessiert.
Gerhard Ecker ist Dekan der Fakultät für Lebenswissenschaften und leitet die Pharmacoinformatics Research Group am Department für Pharmazeutische Chemie. Zu seinen Forschungsschwerpunkten zählen die Entwicklung von Computermodellen zur Vorhersage von Nebenwirkungen, die Analyse der molekularen Basis der Interaktion von Arzneistoffen mit Transportproteinen, sowie das Analysieren und Verknüpfen großer Datenbanken im Bereich Lebenswissenschaften. Er ist zudem wissenschaftlicher Leiter des Zertifikatskurses "Klinische Pharmazie – Medikationsanalyse". (© Sarah Nägele)