Wir bauen ein Gitter aus Proteinen
| 15. Januar 2015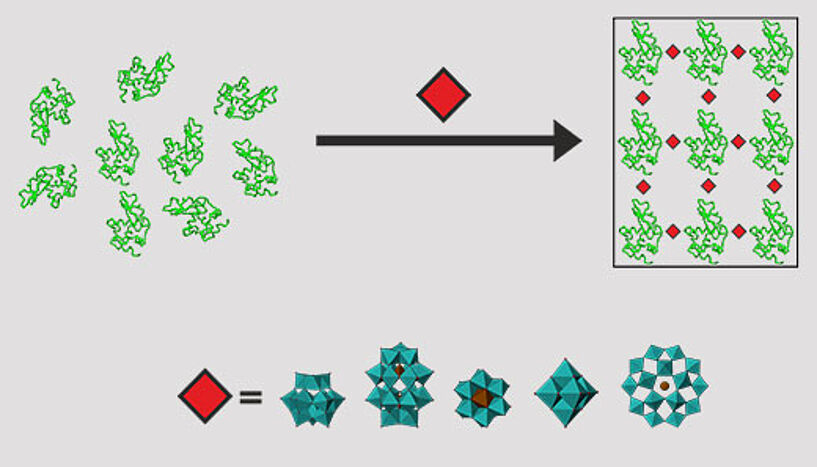
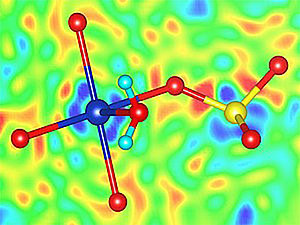
Den positiven Einfluss von Additiven auf die Kristallisation von Proteinen untersucht Annette Rompel vom Institut für Biophysikalische Chemie. (Grafik: Annette Rompel)
Das Jahr der Kristallographie geht zu Ende – nicht aber für die Wissenschaft: Annette Rompel und ihr Team beschäftigen sich mit Molekülen, die für die Proteinkristallisation wichtig sind. Im Journal "ChemBioChem" zeigen sie, wie man mit Hilfe von Polyoxometallaten ein Proteinkristallgitter aufbaut.
Die Röntgenkristallographie ist die am häufigsten verwendete Methode, um die Struktur von Makromolekülen aufzuklären. "Rund 89 Prozent aller Proteinstrukturen der zentralen Strukturdatenbank PDB wurden mithilfe dieser Methode bestimmt", erklärt die Chemikerin Annette Rompel von der Universität Wien. Proteine zu kristallisieren ist für die ForscherInnen jedoch alles andere als ein einfaches Unterfangen und basiert auf dem "Trial and Érror”-Prinzip: "Der Versuch, unbekannte Proteine zu kristallisieren, kann deshalb zu einem sehr zeitaufwändigen, nicht immer erfolgreichen Prozess werden", erzählt Rompel.
Auf der Suche nach dem "universellen Additiv"
Einen positiven Einfluss auf die Kristallisation von Proteinen haben verschiedene kleine Moleküle, Additive genannt. "Sie stabilisieren die Proteine und tragen damit zur Ausbildung eines geordneten Kristallgitters bei", erklärt Rompel. Additive, die hierbei häufig verwendet werden, sind sogenannte zweiwertige Metallionen: Sie stabilisieren die räumliche Proteinstruktur (Proteinkonformation) und begünstigen so die Kristallisation.
Das richtige Additiv ist nicht leicht zu finden, daher möchte das Team vom Institut für Biophysikalische Chemie der Universität Wien ein "universelles Additiv" etablieren, das die Kristallisation zumindest einer bestimmten Proteingruppe ermöglicht. Hier setzen die ForscherInnen große Hoffnungen auf die POMs – kurz für Polyoxometallate –, die sie als "potente Additive" erachten.
Mit negativer Ladung
"In unserer aktuellen Publikation beschreiben wir den Einfluss der POMs als mehrfach negativ geladene Ionen – sogenannte (Poly)Anionen – auf Proteine mit positiv geladenen Oberflächen", berichtet die Wissenschafterin über ihre aktuelle Forschung. Die Polyoxometallate besitzen interessante molekulare Eigenschaften und Formen sowie – bei guter Wasserlöslichkeit – eine hohe negative Ladung. "POMs können positiv geladene Proteine elektrostatisch binden und somit flexible Loops und andere Proteinregionen stabilisieren – die Kristallisation des Proteins wird damit erleichtert", freut sich Rompel über das aktuelle Studienergebnis.
Wo "steckt" Kristallographie drin und woran forschen die KristallographInnen der Universität Wien aktuell? Blicken Sie mit dem uni:view Themenschwerpunkt auf ein erfolgreiches "Jahr der Kristallographie 2014" zurück. |
|---|
Nobelpreis Chemie für Studien zur Funktion und Struktur von Ribosomen
Die bislang bedeutendste Rolle haben POMs bei der Strukturaufklärung des Ribosoms gespielt. Yonath, Steitz und Ramakrishnan haben hierfür 2009 den Chemie-Nobelpreis erhalten. Ribosome sind große RNA-Protein-Komplexe, die in allen lebenden Zellen gefunden werden und für die Protein-Biosynthese verantwortlich sind. "Das bakterielle Ribosom besteht aus einer kleinen und einer großen Untereinheit. Beide zusammen ergeben das komplette Ribosom, wobei die kleine Untereinheit die RNA abliest und an der großen Untereinheit die Aminosäuren zu Polypeptiden verknüpft werden", erklärt die Kristallographin.
Die Struktur des Ribosoms wirft ein Schlaglicht auf das zentrale Dogma der Molekularbiologie über den Informationsfluss zwischen den Biopolymeren DNA, RNA und Protein. "Die Kristallisation des Ribosoms war für die KollegInnen, die dafür den Nobelpreis bekommen haben, eine große Herausforderung – aufgrund der Größe des Moleküls, seiner komplexen Architektur und insbesondere seiner naturgegebenen Flexibilität. Gerade hier hat der Einsatz von POMs zu einer Einschränkung der Flexibilität des Ribosoms geführt und so die Strukturaufklärung wesentlich erleichtert", so Rompel.
Wichtig für Medizin und Biotechnologie
Im Rahmen der aktuellen Studie der Universität Wien ist es Aleksandar Bijelic, Dissertant bei Annette Rompel am Institut für Biophysikalische Chemie, gelungen, ein Protein mit positiv geladener Oberfläche – ein Lysozym von Hühnereiklar – in Gegenwart des POMs "TEW" zu kristallisieren. Die Strukturaufklärung ergab, dass Polyoxometallate Teil des Kristallgitters sind und elektrostatisch mit dem Protein wechselwirken. "Aleksandar Bijelic konnte zeigen, dass das Polyoxometallat die Ausbildung von Protein-Protein-Kontakten ermöglicht, indem durch die negative Ladung des TEW positive Proteinladungen, die sich sonst gegenseitig abstoßen, neutralisiert werden. Somit kann sich ein stabiles Kristallgitter ausbilden – ein Proteinkristall ist geboren", erklärt Annette Rompel die Details.
Krebshemmende Wirkung
Einige POMs zeigen auch tumor-hemmende oder anti-virale Wirkung und sind deshalb auch für die Medizin interessant. "Ihre pharmakologische Wirkung rührt höchstwahrscheinlich von der Tatsache her, dass die POMs in der Lage sind, mit physiologisch wichtigen Proteinen zu interagieren", erklärt Rompel. Da POMs aus frühen Übergangsmetallen bestehen (u.a. Wolfram, Vanadium und Molybdän), können sie mit vielen Kinasen oder Phosphatasen interagieren, indem sie entweder als Inhibitoren (Hemmer) oder Substrat-Analoga an das Enzym binden. "POMs mit einer solchen hemmenden Wirkung blocken dabei das katalytische Zentrum von wichtigen Enzymen und können deshalb pharmakologische Effekte bewirken", so die Studienautorin.
Darüber hinaus stabilisieren die POMs spezifische Enzymstrukturen, die dann kristallisiert mittels Röntgenkristallographie näher untersucht werden können, um mehr über den Wirkungs- bzw. Inhibitionsmechanismus zu verstehen. (red)
Die Publikation "Hen Egg-White Lysozyme Crystallisation: Protein Stacking and Structure Stability Enhanced by a Tellurium(VI)-Centred Polyoxotungstate" (AutorInnen: Aleksandar Bijelic, Christian Molitor, Stephan G. Mauracher, Rami Al-Oweini, Ulrich Kortz, Annette Rompel) erschien im Dezember 2014 im Journal ChemBioChem.