Molekularbiologie: Protein für Gefäßneubildung identifiziert
| 16. Januar 2012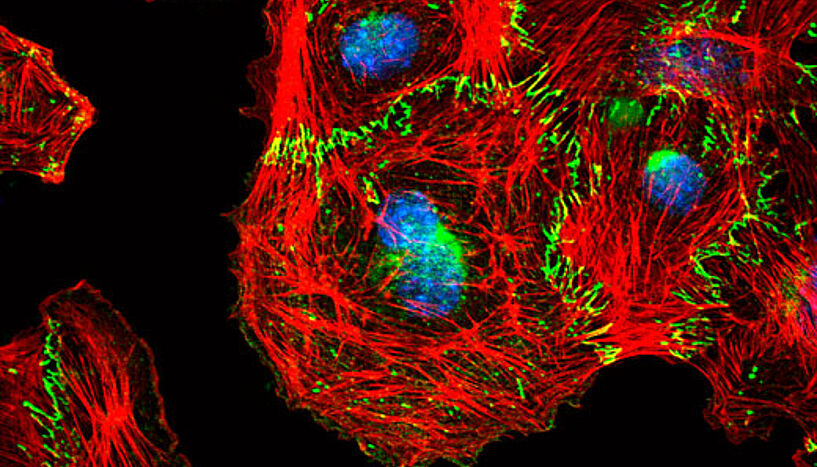
Mikroskopische Aufnahme entstehender Zellkontakte zwischen Endothelzellen. (Foto: Reiner Wimmer).
Wie Zellen während der Entwicklung von neuen Gefäßen ihren Kontakt zueinander regulieren, zeigt das Forschungsteam um Manuela Baccarini von den Max F. Perutz Laboratories. Erstmals wurde die Rolle des Proteins Raf-1 für die Stabilität von Zell-Zell Verbindungen nachgewiesen.
Angiogenese ist der Prozess, durch den neue Blutgefäße aus bestehenden Gefäßen gebildet werden. Sie ermöglicht die Entwicklung des Herz-Kreislauf-Systems im Embryo und ist von entscheidender Bedeutung für die Geweberegeneration bei Erwachsenen. Bei der Angiogenese sprossen Zellen von bereits vorhandenen Gefäßen ab und bilden so neue Gefäße. Die Zellen bewegen sich dabei gemeinsam, also in ständigem Kontakt zueinander. Dieser Prozess wird auch von Tumoren missbraucht, um ihr Wachstum zu fördern.
Neubildung von Gefäßen
Die Forschungsgruppe um Manuela Baccarini an den Max F. Perutz Laboratories beschäftigt sich mit zellulären Signalkaskaden, also wie Informationen von innerhalb oder außerhalb in der Zelle verarbeitet werden. Ein wichtiger Signalweg läuft über das Protein Raf-1. "Wir untersuchten Endothelzellen denen Raf-1 fehlt und mussten feststellen, dass sie sich normal teilen konnten und auch morphologisch nicht von normalen Zellen zu unterscheiden waren", erklärt Reiner Wimmer, Erstautor der Publikation. Dennoch simulierten die ForscherInnen die Angiogenese mit diesen Zellen im Labor. "Wir waren sehr überrascht, dass Zellen ohne Raf-1 nicht mehr gemeinsam, sondern einzeln wanderten."
 | Ohne Raf-1 können Zellen nicht kollektiv wandern und bilden keine kapillarartigen Strukturen in 3D Gelen aus. Für die Videos wurden alle 30 Minuten Einzelbilder aufgenommen und daraus Clips mit jeweils 15 Bildern pro Sekunde erstellt. Video 1: In vitro Gefäßneubildung von typischen Endothelzellen (oben) Video 2: Endothelzellen ohne Raf-1 (unten) (Videos: Reiner Wimmer) | |
|---|---|---|
 |
Die Bedeutung dieser unerwarteten Entdeckung wurde in weiteren Experimenten klar: Raf-1 reguliert während der Angiogenese direkt an der Zellmembran die Anbindung von anderen Zellen an das interne Zellgerüst über so genannte "Adherens Junctions": Sind die Verbindungen zu schwach, zerfallen die Zellverbände. Sind sie zu stark, können sich die Zellen nicht fortbewegen. Unter der Kontrolle von Raf-1 wird die Stabilität von Zell-Zell Kontakten ständig moduliert, um eine kollektive Wanderung zu ermöglichen.
Gleicher Mechanismus unterstützt Krebsentwicklung
Angiogenese spielt physiologisch hauptsächlich in der Embryonalentwicklung eine Rolle. Tumore missbrauchen diesen eigentlich gutartigen Prozess, um ihr Wachstum zu fördern. Erreicht ein Tumor eine bestimmte Größe, werden ihm die Nährstoffe zu knapp. Er veranlasst dann über chemische Signale, dass neue Gefäße vom Körper gebildet werden, um sie direkt an den Blutkreislauf anzubinden. Derzeitige Forschung in der Antiangiogenese-Therapie konzentriert sich auf VEGF-Signalmoleküle, die vom Tumor abgesondert werden, um die Angiogenese einzuleiten. Die Ergebnisse der ForscherInnen eröffnen einen weiteren Ansatzpunkt: Durch die Hemmung von Raf-1 könnte man den Mechanismus der Gefäßneubildung selbst reduzieren und damit die Anbindung des Tumors an die Nährstoffversorgung des Körpers verzögern oder verhindern. (ad)
Das Paper "Angiogenic sprouting requires the fine-tuning of endothelial cell cohesion by the Raf-1/Rok-α complex" (AutorInnen: Wimmer R, Cseh B, Maier B, Scherrer K, Baccarini M) erschien im Fachjournal Developmental Cell.
