Gestresste Bakterien
| 27. Oktober 2010Bakterielle Krankheitserreger infizieren den menschlichen Körper. Eine Infektionskrankheit ist die Folge, und Antibiotika kommen zum Einsatz. Soweit ist uns der Ablauf bekannt. Weniger bekannt ist, dass ein Teil der Bakterien die Behandlung überlebt. Wie, das untersucht die Mikrobiologin Isabella Moll im FWF-Projekt "Neue Strategien in der bakteriellen Stressantwort". Dabei geht sie der Frage nach, wie die Bakterien auf den Stress nach einer Infektion reagieren und wie sie lernen, mit ihrer neuen Umgebung im Körper des Wirts umzugehen.
Salmonellen gelangen - z.B. über Nahrungsmittel - in den menschlichen Körper und werden dadurch einem enormen Stress ausgesetzt. Sowohl die Reaktion des menschlichen Immunsystems, als auch die darauffolgende Behandlung mit Antibiotika führen zu einem zusätzlichen Stress, dem der Großteil der Bakterien - 99,9 Prozent - zum Opfer fallen. Doch ein kleiner, hartnäckiger Rest begibt sich in eine Art Ruhezustand, wartet bis der Antibiotika-Stress vorbei ist und passt sich derweil an die neuen Bedingungen im menschlichen Körper an.
"Nach Absetzen der Antibiotikatherapie kann es durch diese kleine Bakterienpopulation wieder zu einem Aufflammen der Infektion im bereits geschwächten Körper kommen", erklärt Isabella Moll vom Department für Mikrobiologie, Immunbiologie und Genetik. Diese Persistenz der Bakterien stellt deshalb ein großes Problem in der Medizin dar. Zusammen mit ihrem Team aus PhD-StudentInnen und Postdocs will die Wissenschafterin im dreijährigen FWF-Projekt "Neue Strategien in der bakteriellen Stressantwort" herausfinden, warum ein kleiner Teil der Bakterien so "stressresistent" wird, und welcher Stoff dem entgegenwirken könnte.
Selektive Translation
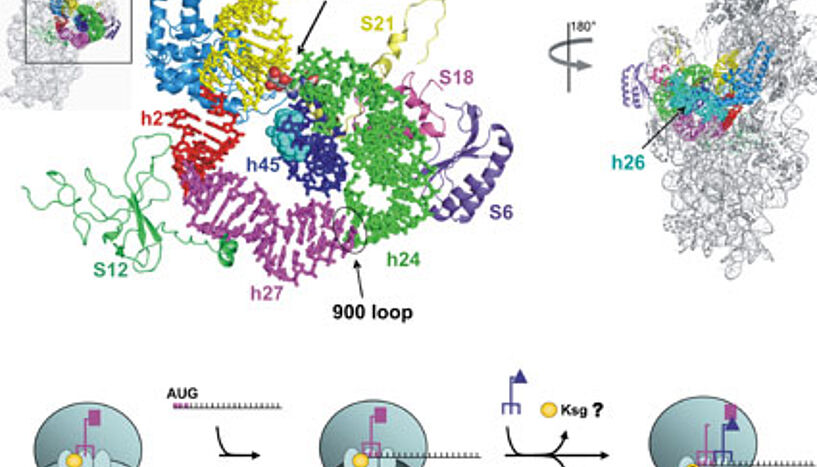
Eine Erklärung für diese Stressresistenz könnte in der RNA der Bakterien liegen, oder besser gesagt in der Wirkung von Stress auf die Translation - die Übersetzung von RNA in Proteine. "Im vorhergehenden Projekt haben wir mit verschiedenen Antibiotika gearbeitet und untersucht, wie das Ribosom und die Proteinbiosynthese dadurch beeinflusst werden", erklärt die Mikrobiologin. Dabei haben die ForscherInnen festgestellt, dass das Antibiotikum Kasugamycin die Translation stoppt, wobei jedoch eine bestimmte Klasse von RNA weiter übersetzt wird.
Diese speziellen RNAs waren bisher nur in Bakterienviren und antibiotikaproduzierenden Bakterien bekannt, konnten aber in Krankheitserregern noch nicht nachgewiesen werden. Das Forschungsteam hat nun herausgefunden, dass eine längere Behandlung der Bakterienzellen mit dem Antibiotikum eine Stressantwort auslöst, die dazu führt, dass bestimmte vorhandene RNAs prozessiert werden und diese dadurch weiter in Proteine übersetzt werden können: Es kommt zu einer sogenannten selektiven Translation.
"Dies ist ein wunderbarer Mechanismus für die Bakterienzelle, denn sie muss somit unter Stress keine neuen Proteine herstellen, um die Translation von RNA in Proteine zu regulieren. Sie schneidet einfach ein Stück der bereits vorhandenen RNA ab und erhält somit ein neues RNA-Set, das zur selektiven Synthese von Proteinen führt, welche die Zelle schützen", beschreibt Moll den Vorgang.
Wenn RNA übersehen wird ...
Da dieser Prozess vorher noch nie beschrieben wurde, betreten die ForscherInnen nun Neuland. "Während die Stressantwort bei Bakterien bereits vielfach studiert wurde, ist bis jetzt noch niemand über diesen Mechanismus gestolpert", freut sich die Mikrobiologin. Warum die WissenschafterInnen in der Dr.-Bohr-Gasse die ersten sind, die diesen Prozess beschreiben, erklärt sich Moll mit den modernen Screening-Methoden: "Die geschnittenen RNA fallen durch den Rost, weil sie alternative Enden haben. In den Screenings werden sie - und somit der gesamte Mechanismus - einfach übersehen." Die Forscherin will die Screening-Methoden nun an diese speziellen RNAs anpassen, um sie genauer untersuchen zu können.
... und den Bakterien beim Überleben hilft
Im Rahmen des aktuellen Projekts wollen die WissenschafterInnen herausfinden, wie diese selektive Translation pathogene Bakterien - im speziellen Salmonella typhimurium - dabei unterstützt, den Antibiotika-Stress im menschlichen Wirt zu überleben. "Anhand einer - im Labor modellierten - Infektion schauen wir uns diesen Mechanismus an und versuchen, ihn zu regulieren", schildert Moll die Vorgangsweise. Zusammen mit ihrem Team simuliert sie dafür die verschiedenen Stressbedingungen, denen die Bakterien während einer Infektion ausgesetzt sind, und analysiert die betroffenen RNAs.
"Ziel ist es, einen Stoff zu finden, der den Prozess der Stressanpassung stoppen könnte und der - nach dem Antibiotikum - auch die restlichen persistenten Bakterien bekämpft", so die Expertin, die hofft, im Laufe der Forschungsarbeiten selbst stressresistent zu bleiben. (ps)
Mag. Dr. Isabella Moll vom Department für Mikrobiologie, Immunbiologie und Genetik leitet das FWF-Projekt "Neue Strategien in der bakteriellen Stressantwort", das von 1. Juli 2010 bis zum 30. Juni 2013 läuft.