Erfinderische marine Mikroorganismen
| 24. März 2014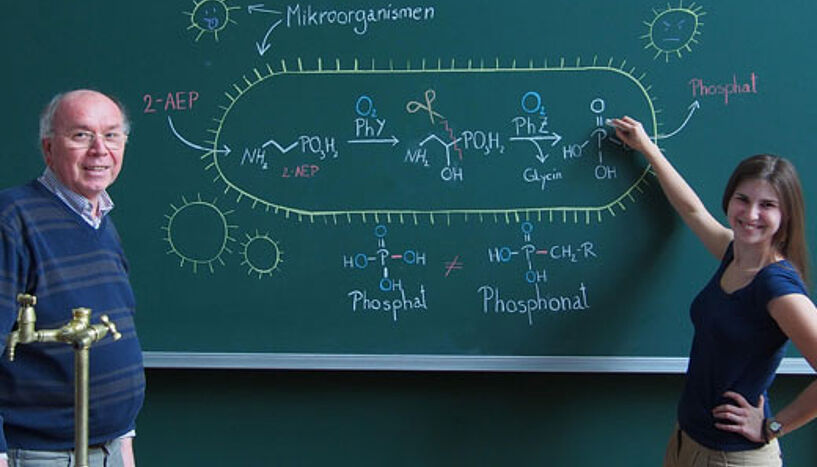
Die ChemikerInnen Friedrich Hammerschmidt und Katharina Schiessl erforschen den biologischen Abbauweg von Phosphonaten in marinen Mikroorganismen. (Foto: Universität Wien)
Der Chemiker Friedrich Hammerschmidt und seine Doktorandin Katharina Schiessl von der Universität Wien haben einen bisher unbekannten biologischen Abbauweg von Phosphonaten in marinen Mikroorganismen erforscht und dazu im renommierten Fachmagazin "PNAS" publiziert.
In der Natur ist Knappheit an lebenswichtigen Ressourcen ein Grund für Pflanzen oder Tiere sich zu spezialisieren. Auch in der Welt der Mikroorganismen ist Anpassung ein oft genutztes (Über-)Lebensrezept. Der Chemiker Friedrich Hammerschmidt und seine Doktorandin Katharina Schiessl von der Universität Wien haben gemeinsam mit einem internationalen Wissenschafterteam aus Kanada einen bisher unbekannten biologischen Abbauweg von Phosphonaten in marinen Mikroorganismen erforscht. Phosphonate stellen die eiserne Phosphorreserve der Biosphäre dar.
Phosphor - ein lebenswichtiger Nährstoff
Phosphor ist einer der wichtigsten Nährstoffe. Jede Zelle benötigt ihn, um zu wachsen und sich zu vermehren. Daher nehmen alle Lebewesen Phosphor aus ihrer Umwelt auf und bauen ihn in unterschiedliche Zellstrukturen ein. Ein wichtiges Beispiel für ein Molekül, das nicht ohne Phosphor auskommt, ist die DNA, die unsere Erbinformation trägt. Die meisten Organismen können Phosphor nur in Form von Phosphat nutzen. Das sind Moleküle, in denen das Phosphoratom an ein Sauerstoffatom gebunden ist, das wiederum an einem Kohlenstoffatom hängt. Diese kommen zwar praktisch überall im Boden vor, allerdings nicht immer in ausreichender Menge, weswegen man sie neben Stickstoff und Kalium Düngemitteln zusetzt.
Phosphate vs. Phosphonate
Es gibt allerdings auch Moleküle, in denen der Phosphor direkt an ein Kohlenstoffatom gebunden ist – ohne Sauerstoff als Bindeglied. Diese Verbindungen nennt man (Organo)Phosphonate. Sie können im Labor hergestellt werden und kommen als Herbizide und Medikamente zum Einsatz. Somit werden sie auch in die Umwelt freigesetzt. Es sind sehr stabile Verbindungen, die weder von Wasser, noch von Luft oder Licht zersetzt werden können.
Phosphonate können aber auch natürlichen Ursprungs sein. Es gibt einige Mikroorganismen, die Phosphonate herstellen, indem sie Phosphate aufnehmen und umbauen. Die am häufigsten in der Natur anzutreffende Verbindung ist die 2-Aminoethylphosphonsäure (2-AEP).
Eiserne Reserven
"Phosphonate stellen die eiserne Phosphorreserve der Biosphäre dar. Bestimmte Mikroorganismen können sie im Falle eines akuten Phosphatmangels verarbeiten und setzen so den enthaltenen Phosphor wieder in Form von Phosphat in die Umwelt frei. Dies entspricht einer Art Phosphorrecycling", erklärt Friedrich Hammerschmidt vom Institut für Organische Chemie der Universität Wien. Die oberflächennahen Meerwasserschichten der Ozeane sind eine solche phosphatarme Zone der Biosphäre. Sie enthalten aber Phosphonate, insbesondere 2-AEP. "Wir wissen, dass es diverse marine Mikroorganismen gibt, die 2-AEP abbauen und damit als Phosphorquelle nutzen können. Die für sie lebensbedrohliche Phosphornot zwang die Mikroorganismen, sich neue, alternative Phosphorquellen zu erschließen", so Hammerschmidt weiter.
Bisher waren zwei verschiedene Wege bekannt, die es Mikroorganismen ermöglichen, 2-AEP als Phosphorquelle zu nutzen. Hammerschmidt und sein Team erforschten nun zusammen mit Kooperationspartnern einen bisher unbekannten biologischen Abbauweg von 2-AEP: Im ersten Schritt dieses Abbauvorgangs bildet ein Enzym (PhY) eine Zwischenstufe, die es dem zweiten Enzym (PhZ) erlaubt, die sehr stabile Phosphor-Kohlenstoff-Bindung zu spalten und somit Phosphat freizusetzen. "Auf diese Weise kann sich der Mikroorganismus in einer akuten Notsituation an den ansonsten unzugänglichen Phosphorreserven der Biosphäre bedienen", meint der Chemiker. Er kann sich somit einen Vorteil in besonders phosphatarmen Habitaten verschaffen.
Internationale Kooperation
Im konkreten Fall haben die Kooperationspartner in Kanada durch Mutation E. coli-Bakterien gezüchtet, die das PhZ-Enzym aus marinen Mikroorganismen produzieren. So war es ihnen möglich, das Enzym in ausreichender Menge zu gewinnen, zu reinigen und seine dreidimensionale Struktur zu bestimmen. Um den Mechanismus aufzuklären, mit dem dieses Enzym arbeitet, hat die Dissertantin Katharina Schiessl das Zwischenprodukt des 2-AEP-Abbaus und einige strukturelle Analoga hergestellt. David Zechels Arbeitsgruppe von der Queen’s University Kingston (Kanada) untersuchte mit Hilfe dieser Verbindungen die Spaltung der Phosphor-Kohlenstoff-Bindung durch das PhZ-Enzym.
Die Arbeitsgruppe von Friedrich Hammerschmidt am Institut für Organische Chemie der Universität Wien beschäftigt sich schon lange mit der Biosynthese und dem Bioabbau von natürlich vorkommenden Phosphonsäuren. Da jährlich viele Tonnen an Phosphonaten in die Umwelt gelangen, ist deren Verbleib in der Biosphäre und damit ein besseres Verständnis des globalen Phosphorkreislaufs von enormem Interesse für die Forschung. (af)
Die Publikation "Crystal structure of PhnZ in complex with substrate reveals a new di-iron oxygenase mechanism for catabolism of organophosphonates" (AutorInnen: Laura M. van Staalduinen, Fern R. McSorley, Katharina Schiessl, Jacqueline Séguin, Peter B. Wyatt, Friedrich Hammerschmidt, David L. Zechel, und Zongchao Jia) erschien kürzlich in "PNAS".



