Dem Timothy-Syndrom auf der Spur
| 12. Juli 2011Im menschlichen Erbgut gibt es 243 spannungsgesteuerte Ionenkanäle. Mutationen an den dazu zählenden Calciumkanälen können zu Erbkrankheiten wie Migräne, Nachtblindheit oder dem mit Autismus und Herzrhythmusstörungen einhergehenden Timothy-Syndrom führen. Katrin Depil und Anna Stary-Weinzinger erforschen mit KollegInnen am Department für Pharmakologie und Toxikologie die Veränderungen an Calciumkanälen, die beim Timothy-Syndrom auftreten. Sie publizierten dazu aktuell in der Fachzeitschrift "Journal of Biological Chemistry".
Ionenkanäle sind Membranproteine, über die Kalium, Natrium und Calcium geleitet werden. Sie steuern elektrische Signale im Nervensystem, verursachen die Freisetzung von Neurotransmittern und sind für das Schlagen des Herzens und die Bewegung der Skelettmuskulatur verantwortlich. Zu den Ionenkanälen gehören die spannungsgesteuerten Calciumkanäle, die sich bei Veränderungen der Membranspannung öffnen und schließen. Diese Öffnungs- und Schließmechanismen der Membranporen sind bislang weitgehend unerforscht. Bekannt ist aber, dass Mutationen die Mechanismen empfindlich stören können und infolge dessen sogenannte "Kanalerkrankungen" entstehen.
Lebensbedrohliche Erkrankung
Eine davon ist das lebensbedrohende Timothy-Syndrom, dem zwei Mutationen (G402S und G406R) im spannungsabhängigen Calciumkanal Cav1.2 zugrunde liegen. Dabei verursacht der Austausch der Aminosäuren in der Kanalpore neurologische Störungen, Autismus, schwere Herzrhythmusstörungen sowie Fehlbildungen, u.a. im Kieferbereich. "Durch die Punktmutationen bleiben die Kanäle länger offen und die Zellen werden mit Calcium förmlich überflutet, was letztendlich zu den vielfältigen Störungen führt", erklärt Steffen Hering, Vorstand des Departments für Pharmakologie und Toxikologie.
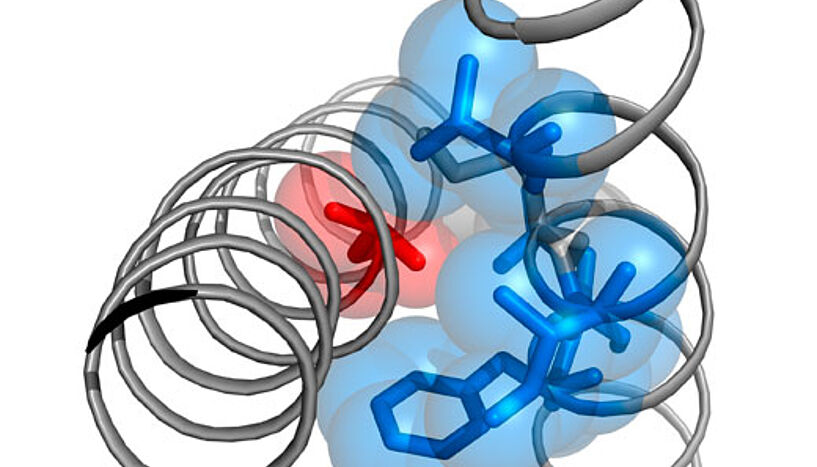
Destabilisierung der geschlossenen Pore
Katrin Depil und Anna Stary-Weinzinger, wissenschaftliche Mitarbeiterinnen am Department, forschen schwerpunktmäßig zu spannungsgesteuerten Calciumkanälen. In der Fachzeitschrift "Journal of Biological Chemistry" beschreiben sie mit weiteren AutorInnen, dass die Timothy-Mutation in einem stark konservierten Strukturmotiv in der Kanalpore auftritt, welches aus kleinen Aminosäuren besteht – Glycinen (G) und Alaninen (A), das "G/A/G/A-Motiv". Der Einbau größerer Aminosäuren, deren Seitenketten nicht wasserlöslich sind, beeinflusste die Kanalöffnungen am stärksten. "Wir gehen davon aus, dass die kleinen Aminosäuren des G/A/G/A-Motivs essenziell für das Abdichten des Kanals sind, während Aminosäuren mit größeren fettlöslichen Seitenketten das Schließen des Kanals behindern. Die Timothy-Mutation führt zu einer Destabilisierung der geschlossenen Pore, weshalb der Kanal sich leichter öffnen lässt", sagt Anna Stary-Weinzinger.
Durch systematische Mutations- und Korrelationsanalysen in spezifischen Regionen der Pore von Calciumkanälen konnte Katrin Depil bereits in ihrer laufenden Dissertation Eigenschaften von Aminosäureseitenketten bestimmen, für die das Öffnen und Schließen der Kanalpore wichtig sind. "Durch Untersuchung weiterer Interaktionen in der Porenregion möchten wir unsere Homologie-Modelle verfeinern und in absehbarer Zukunft die molekularen Ursachen der Timothy-Erkrankung sowie weiterer Kanalerkrankungen an Calciumkanälen noch besser verstehen", erörtert Katrin Depil den gegenwärtigen Stand der Forschung. (ad)
Das Paper "Timothy mutation disrupts link between activation and inactivation in CaV1.2." (AutorInnen: Depil K, Beyl S, Stary-Weinzinger A, Hohaus A, Timin E, Hering S.) erschien am 17. Juni 2011 in der Fachzeitschrift "Journal of Biological Chemistry".