Chemie erleben an der Fakultät für Chemie
Gastbeitrag der Fakultät für Chemie | 20. Februar 2015Anlässlich des 650-Jahr-Jubiläums der Universität Wien öffnete die Fakultät für Chemie ihre Pforten für jedermann. Am 14. Februar 2015 wurde in den Hörsälen und Laboren die Chemie für alle Besucher erlebbar gemacht.

Die Fakultät für Chemie der Universität Wien eröffnete ihre Aktivitäten zum Jubiläumsjahr der "Alma Mater Rudolphina" letzte Woche. Unter dem Titel "Chemie erleben" fanden gleich mehrere Veranstaltungen statt.

Am 12. und 13. Februar 2015 besuchten insgesamt etwa 800 SchülerInnen mit Ihren Chemie-ProfessorInnen die Fakultät, um bei der traditionellen Veranstaltung ChemiKeRleben einen Einblick in das Studienfach zu erhalten. Nach einer Experimentalvorführung gaben VertreterInnen diverser Forschungsgruppen Einblick in ihre wissenschaftliche Arbeit. Seit über 15 Jahren findet diese Veranstaltung unter jenem sonderbaren Titel statt, der als "Vexierbild" die Begriffe Chemie, Chemiker, Leben und erleben verbindet. Durch die gute Zusammenarbeit mit dem Österreichischen Chemielehrerverband können hier jährlich fast 1.000 angehende StudentInnen einen Eindruck von Chemie und der Fakultät an der Universität Wien gewinnen, der für die Studien- und Laufbahnentscheidung hilfreich sein soll.

Am Samstag, 14. Februar, war Tag der Offenen Tür. Vom Kleinkind bis zum Senior reichte die Alterspalette der BesucherInnen. Diesen wurde an mehreren Stationen die Möglichkeit geboten, selbst chemische Versuche durchzuführen. Mit großer Begeisterung stellten Kinder unter der Anleitung von Lebensmittelchemikerinnen selbst "Bubble Tea" her. Ein Fruchtsirup wird aus einer Pipette in eine Schale mit Alginatlösung getropft. Spontan bildet sich um den Tropfen eine Gelatinehülle. Die so gebildeten "Bubbles" werden mit einem Sieb aus der Lösung geholt, mit Wasser nachgewaschen und dann im Getränk der Wahl genossen.

Überraschungen gab es bei den Geschmacks- und Geruchstests, die vom Institut für Lebensmittelphysiologie gestaltet waren. Rote Keramikschalen waren jeweils mit einer Creme gefüllt, die rosarot gefärbt war. Die Probanden konnten davon kosten. Fazit: Nicht alles, was wie Erdbeerjogurt aussieht, schmeckt auch so, und erst das Zusammenspiel mit Aussehen und Geruch macht den "Geschmackseindruck" aus.

Unter Anleitung von Analytischen ChemikerInnen konnten BesucherInnen die Härte ihres mitgebrachten Wassers bestimmen. Die komplexometrische Titration mit EDTA erfasst die Elemente Kalzium und Magnesium, die mit der im Wasser gelösten Kohlensäure bei erhöhten Temperaturen oder beim Verdampfen Kalkrückstände bilden.

Das Institut für Materialchemie, an dem zur Entwicklung "grüner Materialien" geforscht wird, zeigte die Herstellung von Nanopapier. Materialien auf der Basis von Zellulose und anderen nachwachsenden Rohstoffen sind in der Zukunft von großer Bedeutung, um Energie- und Treibhausgasbilanzen unter Kontrolle zu bringen. Durch die physikalisch-chemische Weiterentwicklung klassischer Herstellungsprozesse können die Eigenschaften von Papier und ähnlichen Werkstoffen modifiziert und optimiert werden.

Aus dem Institut für Anorganische Chemie kam ein Gerät zur Röntgenfluoreszenzanalyse zum Einsatz. Die Einladung, Schmuckstücke, Steine, Mineralien und Meteorite zur Untersuchung mitzubringen, fand regen Zuspruch. Die nachweisbaren Elemente geben über die Art des Materials Auskunft. Durch ihr einmaliges Röntgenfluoreszenzverhalten können alle chemischen Elemente, die schwerer als Bor sind, identifiziert werden. Durch dieses zerstörungsfreie Verfahren lässt sich die Zusammensetzung bestimmen. Ohne vorherige matrixabhängige Kalibrierung können mittels derartiger Untersuchungen nur halbquantitative Aussagen erreicht werden.

Die beiden Experimentalvorführungen um 10.30 Uhr und 14.30 Uhr fanden vor vollen Hörsaalrängen statt. Nach der Begrüßung durch Vizedekan und Studienprogrammleiter Lothar Brecker führte Norbert Kandler durch die Chemie der letzten 650 Jahre. Zu Beginn wurde die Unterzeichnung der Gründungsurkunde mit selbstgemachter historischer Tinte stilgerecht nachvollzogen.

Schwarzpulver, als "Donnerkraut" bezeichnet, war im Gründungsjahr der Universität Wien schon etabliert. Die Zubereitung aus den Grundkomponenten wurde von einem Gast übernommen. Schwarzpulver ist eine Mischung aus Holzkohle (Kohlenstoff), Schwefel und Salpeter (Kaliumnitrat), die im Mörser zu einem dunkelgrauen Pulver verrieben werden. Die Mischung kann gefahrlos mechanisch belastet werden, reagiert aber beim Entzünden fulminant, wie alljährlich zahlreiche schwere Verletzungen beim Herstellen von Böllern beweisen.

Die fulminante Wirkung des "Donnerkrauts" wurde durch Abfeuern einfacher "Kanonen", hergestellt aus Kartonröhren und Korkringen, demonstriert. Lautes Knallen, mächtiges Mündungsfeuer und starke Rauchentwicklung beeindruckten die BesucherInnen im Saal.

Alchemie markiert die wesentliche Entwicklung der ersten Jahrhunderte. Im Zentrum stand dabei die Suche nach Gold. Ein Freiwilliger durfte sich daran versuchen aus "Höllenstein" (Silbernitrat) in einer geheimnisvollen Lösung unter Zugabe der "Quintessenz" (goldfarbener Blütenhonig) Gold herzustellen.
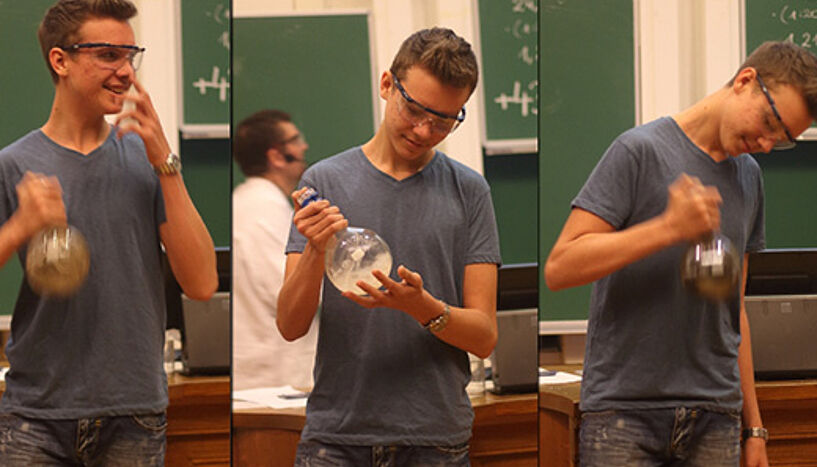
"Scheinbar war die durch Schütteln eingebrachte Energie nicht ausreichend, sodass der Kolben endlich nur mit einem Silberspiegel überzogen war", so lautete die alchemistische Erklärung. Für den Chemiker war klar, dass aus der Silberlösung nur Silber entstehen konnte.

Erst gegen Ende des 19. Jahrhunderts führte Bernhard Tollens die nach ihm benannte Nachweisreaktion für reduzierende Zucker ein, die durch die Ausbildung eines Silber-Spiegels auch die Glukose im Honig bestätigt. Die Konzeption des Experiments in der Vorführung kombiniert diesen chemischen Nachweis mit den Vorstellungen und Begriffen der Alchemie.

Experimente mit der Verbrennung von Substanzen illustrierten die Idee zur "Phlogiston-Theorie": Jeder Stoff gebe beim Verbrennen jene geheimnisvolle Substanz ab, die in ihm gebunden war. Beim Verbrennen von Stahlwolle (Eisen) auf einer Waage wurde die Massezunahme durch Oxidbildung gezeigt.

Nach Äther wurde Lachgas als Narkosegas entdeckt. Die spektakuläre Verbrennung von Schwefelkohlenstoff in reinem Lachgas, die unter blendend hellem, blauen Leuchten und jaulendem Ton erfolgt ist, war ein klassisches Jahrmarktexperiment.

Der österreichische Chemiker und Unternehmer Carl Auer von Welsbach hat um 1900 durch zahlreiche Entdeckungen und Neuerungen wichtige Impulse gesetzt. Der Gasglühstrumpf verbesserte die Lichtausbeute von Gaslichtern enorm. Im Bild sieht man verflüssigtes Methan (Erdgas), das brennend aus einer Eprouvette geleert wird, den Raum aber kaum wesentlich erhellt.

Etwa zeitgleich mit dem amerikanischen Erfinder Thomas Alva Edison experimentierte Auer von Welsbach mit Kohlefäden zur Entwicklung elektrischer Beleuchtung. Eine 0,5 mm Bleistiftmiene unter einer unten offenen mit Helium gefüllten Glocke funktioniert als Glühlampe. Im Experiment wurde gezeigt, dass Kohlefäden durch die starke Erwärmung bei Stromfluss mit der Luft reagieren, also abbrennen. Aus diesem Grund mussten Glühbirnen mit einem sauerstofffreien Gasgemisch gefüllt werden.

Damals... Wie wohl das berühmte Foto von der Eröffnung des Hörsaals im Jahr 1922 entstanden ist? Da musste mit einem Magnesiumblitz für die erforderliche Helligkeit gesorgt werden.

Und heute... Beim Abbrennen leuchtet Magnesium extrem hell. Da es sehr unedel ist, lässt es sich leicht entzünden und brennt rasch ab. Weil das emittierte Licht auch einen starken blauen und ultravioletten Anteil hat, ist das Licht weniger gelblich als bei einer klassischen Glühbirne.

Endlich im zwanzigsten Jahrhundert angekommen, bildete ein mit etwa 80 Liter Wasserstoff gefüllter Ballon das Modell des legendären Zeppelins "Hindenburg".

Die Zündung des Ballons erfolgte durch eine Technologie des 21. Jahrhunderts, durch einen Mobiltelefonanruf aus dem Auditorium – "… wir sind im Jahr 2015 angekommen!" Wäre der Ballon mit Knallgas oder einer Wasserstoff-Luft-Mischung gefüllt, so käme es zu einer so starken Explosion, dass zumindest die Fenster des Hörsaals bersten würden. Auch die Hindenburg explodierte nicht, sondern brannte ab, wodurch sie allerdings abstürzte. Wegen der Verwirbelung beim Zerplatzen der Ballonhülle kommt es allerdings zu einem lauten Knall, da teilweise eine Gasmischung Wasserstoff/Luft entsteht.

Bis zum Ende der Veranstaltung um 17 Uhr herrschte reges Treiben an der Fakultät für Chemie. Die BetreuerInnen der Experimentierstationen konnten viele Fragen zur Chemie im Alltag beantworten. Viele begeisterte Gäste gaben den Eindruck eines gelungenen Events. (Text und Fotos: Johannes Theiner, Fakultät für Chemie)
