Das Hirn und sein Hüter
| 15. Dezember 2014Winfried Neuhaus und sein Team an der Universität Wien untersuchen biologische Barrieren im menschlichen Körper. Die wohl dichteste darunter ist die Blut-Hirn-Schranke: Hier sind die Zellen so eng miteinander verstrickt, dass ein Vorbeikommen unmöglich scheint. Oder doch nicht?
Damit ein Wirkstoff – z.B. ein Epilepsie-Medikament – ins Hirn gelangen kann, muss er zuerst an einer der stärksten biologischen Barrieren vorbei, die es im Körper gibt: der Blut-Hirn-Schranke. Hier sind die Zellen extrem dicht miteinander verbunden: Ungebetene Gäste – wie Krankheitserreger oder Giftstoffe aus dem Blutkreislauf – kommen nicht unbemerkt hinein.
Manche müssen aber rein, wie Glukose als wichtigster Nährstoff der Neuronen. Für sie gibt es nur einen Weg: direkt durch die Zelle – und an einer Security-Mannschaft aus hochspezialisierten Transportproteinen vorbei: "Diese bestimmen, welche Substanzen eingelassen werden und welche nicht", erklärt Winfried Neuhaus von der Universität Wien.
Die Barriere kontrollieren
Biologische Barrieren wie die Blut-Hirn-Schranke – Winfried Neuhaus und sein Team untersuchen auch biologische Barrieren in der Lunge und den Nieren – sind eine Herausforderung für die pharmazeutische Chemie. Hier sucht man stets nach Wirkstoffen, die rasch an ihren Bestimmungsort im menschlichen Körper gelangen. Dabei will man die biologischen Barrieren aber auch nicht zerstören und so den Weg für Krankheitserreger ebnen.
Letzteres passiert z.B. beim Einsatz des Schlaganfall-Medikaments t-PA: Es löst zwar das Blutgerinnsel im Gehirn auf, schädigt aber die Blut-Hirn-Schranke. Für dieses Szenario haben die Forscher rund um Winfried Neuhaus ein "In-vitro-Modell" erfolgreich entwickelt und bereits zwei Substanzgruppen identifiziert, die das Potenzial haben, die Blut-Hirn-Schranke beim Schlaganfall zu stabilisieren. Sie werden nun in vivo weiter getestet. In Kooperation mit Verena Dirsch und ihrem Team am Department für Pharmakognosie werden Inhaltsstoffe aus Pflanzen oder synthetische Derivate auf ähnliche Wirkungsweisen überprüft.
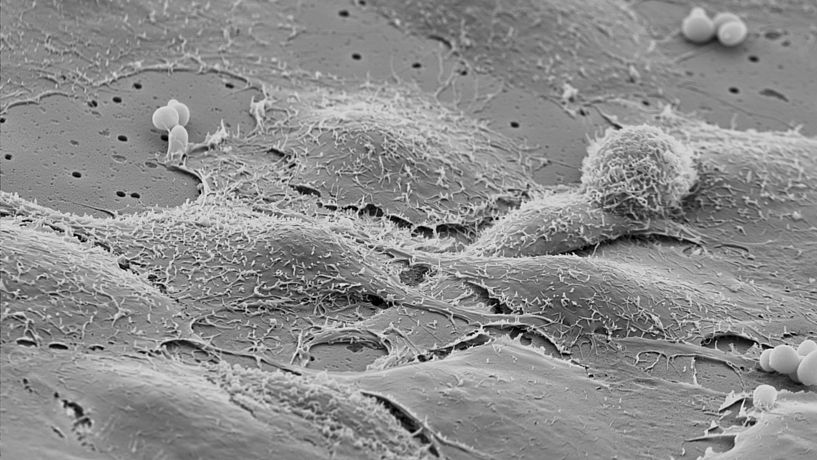
Das Bild zeigt Zellen eines In-vitro-Modells der Blut-Hirn-Schranke, die auf einer porösen Kunststoffmembran zusammenwachsen, um später einen dichten Zellrasen zu bilden – aufgenommen mit einem Rasterelektronenmikroskop. (Foto: Winfried Neuhaus, Daniela Gruber/Universität Wien)
Bekannte Wirkstoffe – neu eingesetzt
Auch für die Lunge haben die Wissenschafter ein Zellkulturmodell aufgebaut: "Hier untersuchen wir, was bei Hyperoxie mit der biologischen Barriere und den Transportproteinen passiert", so Neuhaus, der in der Forschung nicht nur zwischen Hirn und Lunge, sondern auch zwischen dem Department für Pharmazeutische Chemie der Universität Wien und der Klinik für Anästhesiologie der Universität Würzburg hin und her pendelt. Hyperoxie kommt bei künstlicher Beatmung häufig vor: Im Gegensatz zum Schlaganfall, wo die Sauerstoffzufuhr zu den Zellen abgeschnitten wird, gelangt hier zu viel Sauerstoff in das Gewebe hinein.
Wieder lautet das Forschungsziel: Wirkstoffe finden, die die biologische Barriere stabilisieren. Das müssen aber nicht zwangsläufig neue Wirkstoffe sein: Neuhaus und Co. haben es sich zur Aufgabe gemacht, auch bereits zugelassene Medikamente auf ihr Potenzial im Bereich biologischer Barrieren zu überprüfen.
Das umstrittene HES
Es gibt aber noch einen Grund, warum Neuhaus es für "gar nicht unklug" hält, auch bei den "bewährten" Medikamenten genauer hinzuschauen: "Früher waren die Regulatorien noch nicht so streng wie heute", gibt er zu bedenken. Mit einem Wirkstoff, der in den 70er Jahren zugelassen wurde, beschäftigt er sich besonders intensiv: mit Hydroxyethylstärke, kurz HES – einer Kolloidlösung aus Erdapfel- oder Maisstärke, die als künstlicher Blutplasmaersatzstoff bei akutem Blutverlust eingesetzt wird.

Winfried Neuhaus im Labor am Pharmaziezentrum der Universität Wien. Er hat die Blut-Hirn-Schranke im Zellkulturmodell nachgebaut und testet, wie verschiedene Substanzen auf diese biologische Barriere wirken. (Foto: Universität Wien)
|
|---|
Die Dosis macht das Gift
Im Rahmen einer von KollegInnen am Universitätsklinikum Würzburg initiierten Studie konnte Winfried Neuhaus im Zellkulturmodell zeigen, dass HES bei zu hoher Dosierung zum Absterben von Nierenzellen führt. Auch die entzündungshemmende Wirkung, die dem Medikament jahrelang zugesprochen wurde, konnte im In-vitro-Nierenmodell nicht nachgewiesen werden.
"Wir haben gezeigt, dass weder die Größe der HES-Moleküle – für die neueren HES-Präparate wurde mit noch besseren, kleineren Molekülen geworben – noch die Herkunft der Stärke – Erdapfel oder Mais – noch die Zusammensetzung der Lösung eine Rolle spielt: Das Molekül selbst macht den Schaden", erklärt er: "Diese Arbeiten sind besonders gut zitiert: Denn als die erste Studie 2011 publiziert wurde, stand HES, bzw. einer seiner stärksten Befürworter, gerade im Zentrum eines wissenschaftlichen Skandals."
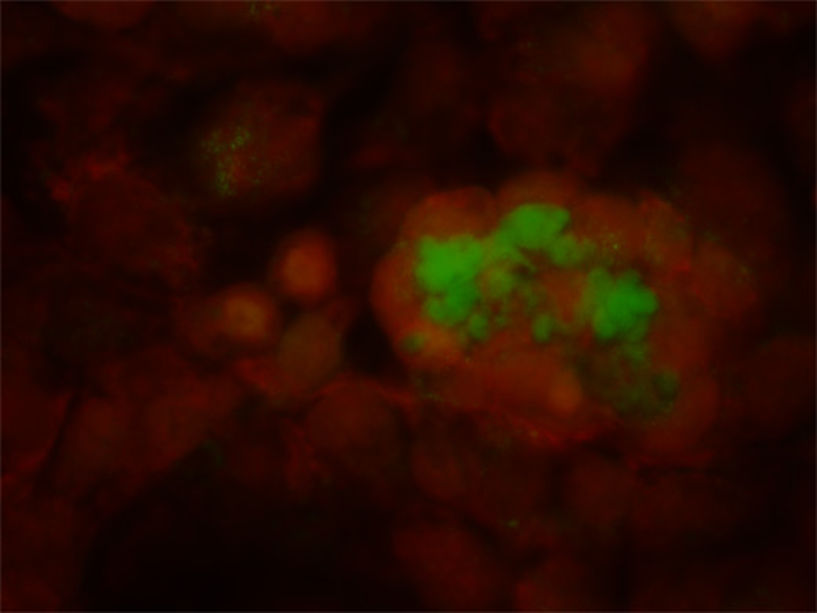
Das Bild zeigt die Aufnahme von fluoreszenzmarkiertem HES (grün) in Nierenzellen (HK-2 Zellen, orange). (Foto: Winfried Neuhaus/Universität Wien)
"Es hat sich gezeigt, dass einige klinische Studien zu den positiven Effekten von HES schlichtweg erfunden waren", erzählt Winfried Neuhaus, "dazu kommt, dass Autoren von Studien zu den Nebenwirkungen von HES – etwa Nierenschäden oder schlimmstenfalls erhöhte Sterblichkeit im Fall von Sepsis– von Pharmafirmen unter Androhung von rechtlichen Schritten ersucht worden sind, ihre Artikel zu korrigieren." Die In vitro- und In vivo-Studien von Neuhaus und seinen KollegInnen stützen die Ergebnisse von späteren klinischen Studien, die letztlich 2013 auch dazu geführt haben, dass der Einsatz von HES für bestimmte Anwendungen von der Europäischen Medikamentenbehörde verboten wurde.
Genauer hinschauen
Winfried Neuhaus freut sich über die internationale Aufmerksamkeit für seine HES-Studien; noch viel wichtiger ist ihm allerdings herauszufinden, wie das HES überhaupt in die Zelle hineinkommt – womit wir wieder zurück bei den biologischen Barrieren wären. "Wenn man einmal weiß, wie ein Wirkstoff die Barriere überwindet, dann kann man weiter überlegen: Hemmt man, umgeht man oder nützt man den Aufnahmeweg aus …", kommt der Forscher ins Sinnieren.
Seine Lieblings-Herausforderung ist aber doch die Blut-Hirn-Schranke geblieben, mit der sich der Biotechnologe schon in Dissertation und Habilitation auseinander gesetzt hat – und die er, als begeisterter Profi-Tischfußballspieler, gerne auch mit einem Fußball-Gleichnis erklärt: Darin ist die Blut-Hirn-Schranke die Abwehr, das Transportprotein der Torhüter und Winfried Neuhaus wohl der Stürmer, der den Ball – also den Wirkstoff – gezielt einlochen will. (Text: br/Video: ps)
