Wenn Schwefel spurlos verschwindet
16. August 2018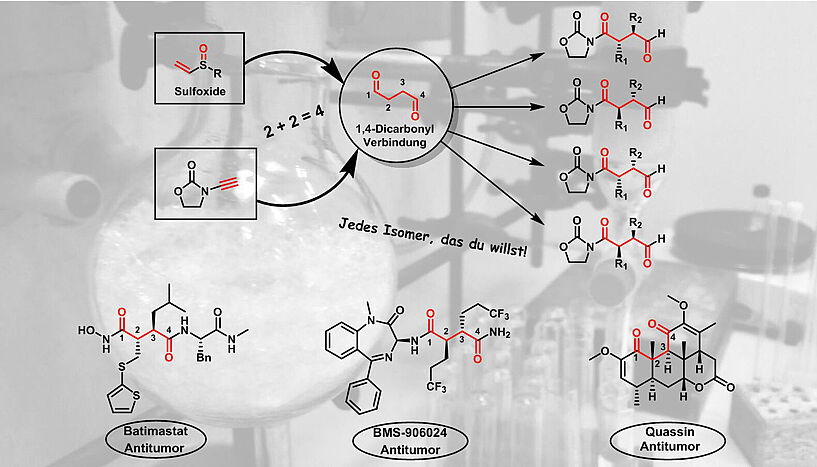
Selektive Synthese von 1,4-Dicarbonylverbindungen mit Sulfoxiden sowie bedeutende Wirkstoffvertreter, die die 1,4-Dicarbonyleinheit enthalten (© Nuno Maulide Group).
Neue einfache Reaktion, um "verwandte" biologisch aktive Moleküle herzustellen
In vielen Naturprodukten und Medikamenten spielen Dicarbonyle eine wesentliche Rolle – die Herstellung einiger solcher Verbindungen ist aber eine Herausforderung. In ihrer aktuellen Studie ist es Nuno Maulide und seinen Mitarbeitern von der Fakultät für Chemie der Universität Wien gelungen, eine neue Syntheseroute für diese Moleküle zu entwickeln. Sie nutzen dazu oxidierte Schwefelverbindungen, ohne dass Schwefel selbst im Produkt auftaucht. Die Ergebnisse dazu erscheinen aktuell in der renommierten Fachzeitschrift "Science".
Wir benötigen ständig neue Moleküle: Innovative Medikamente müssen entworfen und getestet, funktionelle Materialen hergestellt werden – eine Aufgabe für organische ChemikerInnen. Diese analysieren zunächst die funktionellen Gruppen im Zielmolekül und wählen danach ihre Strategie, um eine neue Substanz zu synthetisieren.
Für manche Moleküle ist es nicht so einfach, eine passende Strategie zu finden, wenn die Abstände der Funktionalitäten nicht der "natürlichen" Polarität der möglichen Ausgangsstoffe entsprechen. Das klassische Beispiel hierfür sind Verbindungen mit zwei Kohlenstoff-Sauerstoff-Doppelbindungen (sogenannte "Carbonyl"-Gruppen), die durch vier Kohlenstoffe voneinander getrennt sind. "Diese sogenannten 1,4-Dicarbonylverbindungen sind wesentlich schwerer herzustellen als die entsprechenden 1,3- oder 1,5-Analoga, denn in diesen Fällen ist eine sogenannte "Umpolung" eines der Reaktionspartner notwendig", erklärt Nuno Maulide, Professor für Organische Synthese an der Fakultät für Chemie der Universität. Dies ist ein großes Manko, besonders da 1,4-Dicarbonyle in vielen Naturprodukten, Medikamenten und einer Reihe an medizinisch verwendeten Enzyminhibitoren vorkommen.
Nuno Maulide und seine Mitarbeiter vom Institut für Organische Chemie der Universität Wien haben nun eine neue Syntheseroute für diese Moleküle entwickelt, bei der oxidierte Schwefelverbindungen, sogenannte Sulfoxide, als Reagenzien zum Einsatz kommen. "Wir machen uns mehrere Eigenschaften des Schwefels zunutze, ohne dass Schwefel selbst im unserem Produkt auftaucht", erklärt Immo Klose, DOC-Stipendiat der Österreichischen Akademie der Wissenschaften und Co-Autor der Studie: "Diese Reaktion ist faszinierend: Es ist nicht auf den ersten Blick ersichtlich, wie aus den Ausgangsstoffen das Produkt entsteht". In der Tat verlässt der Schwefel während der Reaktion das reaktive Zwischenprodukt, ChemikerInnen sprechen in diesem Fall von einer "traceless reaction" ("spurlosen Reaktion").
Die Forscher konnten außerdem zeigen, dass jedes der vier möglichen Isomere selektiv durch die Wahl des richtigen Sulfoxids erhalten werden kann. "Unsere Sulfoxide haben zwei Wahlmöglichkeiten: den Schwefel und die beiden benachbarten Kohlenstoffe. Daraus ergeben sich vier mögliche Kombinationen", erklärt Dainis Kaldre, ehemaliger Postdoc am Institut für Organische Chemie und Co-Erstautor. "Das Besondere ist, dass jede dieser vier Möglichkeiten zu einer anderen Konfiguration im Reaktionprodukt führt“, sagt Kaldre. Die Möglichkeit, alle Isomere mit derselben Methode herzustellen, macht diese Reaktion extrem nützlich und vielseitig.
Neue Wirkstoffmoleküle freigeschalten
"Die Vielfalt unserer Methode kann für eine enome Anzahl an neuen möglichen Wirkstoffbausteinen genutzt werden, die vorher nicht zugänglich waren", erklärt Maulide. Für die aktuelle Publikation in Science stellte die Arbeitsgruppe um Maulide auf einfachem Wege Matrix-Metalloproteinase-Inhibitoren her. "Zuvor gab es keine gute Möglichkeit diese Verbindungen herzustellen; es war vor allem schwierig, eine bestimmte Konfiguration selektiv zu erhalten. Mit unserer Methode lassen sich alle vier möglichen Produkte nach Belieben herstellen", freut sich Maulide.
Die reaktive Spezies, mit der die Sulfoxide zur den Produkten überführt werden, gehört zu den exotischen Zwischenstufen der "Vinylkationen". Maulide erforscht diese im Rahmen des prestigeträchtigen ERC Consolidator Grants, der mit rund zwei Millionen Euro Forschungsgeld dotiert ist. "Es ist bemerkenswert, wie einfach Grundlagenforschung an exotischen Molekülen zu Durchbrüchen für unsere Gesellschaft führen kann", so Maulide abschließend.
Publikation in "Science"
"Stereodivergent synthesis of 1,4-dicarbonyls by traceless charge–accelerated sulfonium–rearrangement": Dainis Kaldre, Immo Klose und Nuno Maulide. In Science 2018
DOI: 10.1126/science.aat5883
Wissenschaftlicher Kontakt
Univ.-Prof. Dr. Nuno Maulide
Institut für Organische ChemieUniversität Wien
1090 - Wien, Währinger Straße 38
T +43-1-4277-521 55
M +43-664-60277-521 55
nuno.maulide@univie.ac.at
Rückfragehinweis
Stephan Brodicky
Pressebüro der Universität WienUniversität Wien
1010 - Wien, Universitätsring 1
+43-1-4277-175 41
+43-664-60277-175 41
stephan.brodicky@univie.ac.at
Downloads:
Maulide_Science_web.jpg
Dateigröße: 174,41 KB
