Von Schwefel zu Kohlenstoff
24. Januar 2017Nuno Maulide erforscht chirale chemische Elemente. Unter Chiralität versteht man die Eigenschaft von Objekten, in zwei spiegelbildlichen Formen vorzuliegen, die nicht miteinander zur Deckung gebracht werden können und sich daher zueinander wie unsere linke und rechte Hand verhalten. In seiner jüngsten Arbeit ist es Maulide und seinem Team gelungen, zwischen zwei verschiedenen Elementen – Schwefel und Kohlenstoff – einen so genannten Chiralitätstransfer durchzuführen: Er übertrug die chirale Information über hochselektive Umlagerungsprozesse von Schwefelverbindungen auf ein Kohlenstoffgerüst. Mit der neuen Methode eröffnen sich neue Wege zur Synthetisierung von bioaktiven Molekülen für die Arzneimittelforschung.
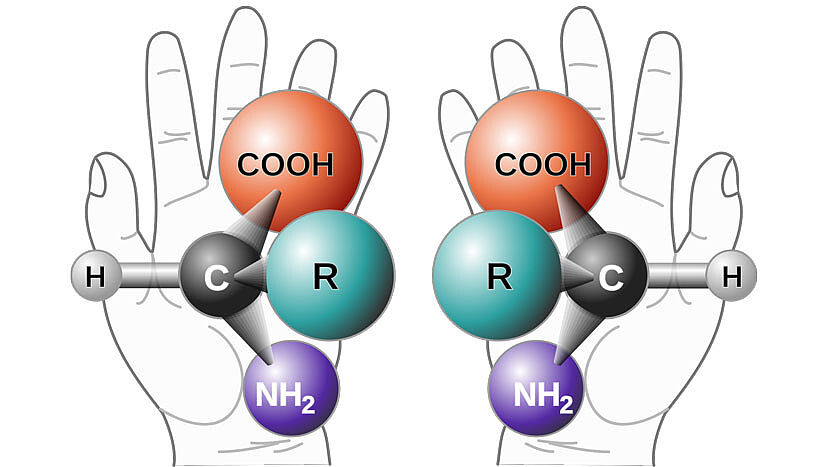
Eine Vielzahl der Moleküle, die für das Leben essentiell sind, sind chiral: beispielsweise Kohlenhydrate, RNS und DNS und auch Aminosäuren. Das bedeutet, dass für diese Moleküle eine "linksdrehende" (äquivalent zur linken Hand) und eine "rechtsdrehende" (äquivalent zur rechten Hand) Form existieren können. Diese beiden Formen nennt man "Enantiomere". In unseren Körpern (und denen anderer Organismen) ist nur eine Enantiomerenform präsent – und dieser Umstand hat großen Einfluss auf jene chemischen Reaktionen, die in uns ablaufen und das Leben bedingen.
ChemikerInnen sehen in chiralen Pharmazeutika ein immer größer werdendes Potenzial in der Arzneimittelforschung. Die Synthese solcher Moleküle in enantiomerenreiner Form ist bis heute eine große Herausforderung in der organischen Synthese. Die Gruppe von Nuno Maulide am Institut für Organische Chemie hat sich – zusammen mit KollegInnen des Instituts für Theoretische Chemie – mit dem Transfer von Chiralität zwischen verschiedenen Atomen und Molekülen befasst und dabei bahnbrechende Ergebnisse erzielt.
Wie sind chirale Moleküle aufgebaut?
"Grundsätzlich enthalten organische Moleküle mehrere Kohlenstoffatome. Wir wissen, dass Kohlenstoff vier chemische Bindungen zu anderen Elementen ausbildet – so werden beispielsweise lange Ketten und komplexe Moleküle gebildet", erklärt Nuno Maulide, Professor für Organische Synthese an der Universität Wien. "Sollten alle vier Substituenten an einem Kohlenstoffatom unterschiedlich sein, so stellt dieser Kohlenstoff ein chirales Zentrum dar. Und somit ist das entsprechende Molekül, in dem dieser Kohlenstoff eingebaut ist, ebenso chiral", so der portugiesische Chemiker.
Andere Elemente können ebenso chiral sein – und ihre Chiralität auf Kohlenstoff übertragen
Kohlenstoff ist aber nicht das einzige Element des Periodensystems, das chiral sein kann. Schwefel, ein oftmals vernachlässigtes Element, kann ebenso vier unterschiedliche Substituenten haben. "Chiraler Schwefel wird oft übersehen, wenn ChemikerInnen von chiralen Elementen reden", sagt Dainis Kaldre, Postdoc in der Maulide-Gruppe und Erstautor der Studie. "Wir fragten uns also: Kann die chirale Information des Schwefels auf Kohlenstoffe übertragen werden?", ergänzt Daniel Kaiser, Coautor der Arbeit. Dem Team ist es nun mit der neuentwickelten Methode gelungen, mehrere chirale Moleküle mit potenziell bioaktiven Eigenschaften zu synthetisieren.
"Man speichert chirale Information am Schwefel – diese kann leicht generiert werden – und verwendet eine, von uns neu entwickelte, chemische Reaktion um sie abzurufen und auf ein Kohlenstoffatom zu übertragen, wo sie besonders wertvoll ist. Um ehrlich zu sein waren wir überrascht, wie leicht das funktioniert", sagt Maulide. Um mechanistische Details besser zu verstehen, wandte sich das Team an die Gruppe von Leticia González am Institut für Theoretische Chemie, mit der eine langjährige Kooperation besteht. "Uns war es möglich ein Modell zu entwerfen, das die Resultate sehr schön beschreibt", betont Gonzalez. "Und das Beste ist, dass einige unserer Voraussagen das Potenzial haben zu neuen Reaktionen zu führen – wir werden also noch eine Weile beschäftigt sein“, so Maulide abschließend.
Publikation in "Angewandte Chemie"
"Asymmetrische Redoxarylierung: Chiralitätstransfer von Schwefel zu Kohlenstoff durch sigmatrope Sulfonium [3,3]-Umlagerung" Dainis Kaldre, Boris Maryasin, Daniel Kaiser, Leticia González und Nuno Maulide, in: Angewandte Chemie, 2017.
DOI: 10.1022/acie.201610105
http://onlinelibrary.wiley.com/doi/10.1002/ange.201610105/full
Wissenschaftlicher Kontakt
Univ.-Prof. Dr. Nuno Maulide
Institut für Organische ChemieUniversität Wien
1090 - Wien, Währinger Straße 38
T +43-1-4277-521 55
M +43-664-60277-521 55
nuno.maulide@univie.ac.at
Rückfragehinweis
Mag. Alexandra Frey
Media Relations ManagerUniversität Wien
1010 - Wien, Universitätsring 1
+43-1-4277-17533
+43-664-8175675
alexandra.frey@univie.ac.at
Downloads:
19517956123_07f7da001b_o_c__Universitaet_Wien_derknopfdruecker.com.jpg
Dateigröße: 2,97 MB
19_feature4_21.jpg
Dateigröße: 117,38 KB
2000px-Chirality_with_hands.jpg
Dateigröße: 204,03 KB