Molekulare Kletten: Von Peptiden getriebene Selbstorganisation im Mikrometerbereich
29. September 2021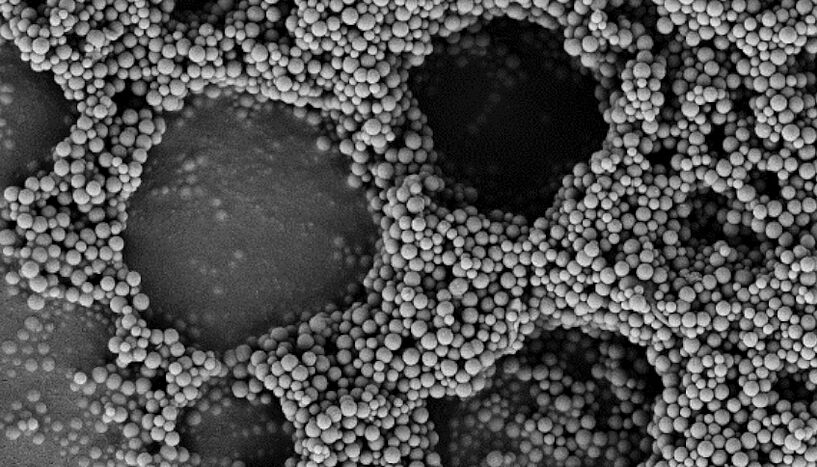
Aufnahme mit Rasterelektronenmikroskop von Strukturen ähnlich wie Bienenwaben: Peptide mit der Fähigkeit zur Selbstorganisation ordnen Kolloide zu neuen, größeren Strukturen an (© Freddy Kleitz, Michael Reithofer et al.)
Chemiker*innen demonstrieren neuen Ansatz zur Selbstorganisation von Kolloiden
Manchmal können eben doch auch kleine Kräfte vergleichsweise Großes bewegen: In einer Studie in "Angewandte Chemie" demonstrieren Chemiker*innen von der Universität Wien eine Methode, wie kurzkettige Peptide die Selbstorganisation von vergleichsweise großen Nano-Teilchen zu neuen Strukturen im Mikrometerbereich anstoßen können. Die um die Partikel angelagerten Peptide geben bei der Selbstorganisation den Ton an; sie kletten die Partikel in bestimmte Formen zusammen. Der Ansatz könnte eine Grundlage für das Design neuartiger Materialien mit verschiedenster Anwendung sein, z.B. von porösen Strukturen als Träger von Wirkstoffen.
Die Selbstorganisation (Selbstassemblierung) von Molekülen ist ein bekanntes, etabliertes Konzept der supramolekularen Chemie. Ungeordnete Moleküle organisieren sich durch supramolekulare Wechselwirkungen zwischen den einzelnen Einheiten spontan in größere Strukturen. Die Selbstorganisation funktioniert auch bei Nanopartikeln: Dabei machen sich Forscher*innen bestimmte funktionale Gruppen, die den Teilchen anhängen, zu Nutze, um die Organisation dieser Kleinstpartikel in eine bestimmte Richtung anzustoßen und darauf aufbauend neuartige Materialien zu designen.
"In unserer Studie haben wir Peptide mit der Fähigkeit zur Selbstorganisation in bestimmte Formen genutzt, um Siliziumdioxid-Nanopartikel mit einem Durchmesser von immerhin 100 Nanometer in größere, von uns gewollte Strukturen zusammenschließen zu lassen", sagt Studienautor Freddy Kleitz vom Institut für Anorganische Chemie – Funktionelle Materialien.
Der Nutzen von kurzkettigen Peptiden, besonders sogenanntem Diphenylalanin, als Treiber für die Selbstorganisation von Molekülen in neuartige, größere Formen (Röhrchen, Fasern, Membranen etc.) war bereits bekannt. Ein Team um Michael Reithofer vom Institut der Anorganischen Chemie entwickelte in der aktuellen Studie Synthesemethoden, um Diphenylalanin-Peptide chemisch an Kolloide anzuhängen. Kolloide sind kleine Festkörper mit einer Größe im Nanometerbereich, die in einem homogenen Medium fein verteilt sind.
"Unsere Peptide haben die Selbstorganisation angeleitet: Sie können die Oberfläche der kleinen Teilchen ummanteln und die Partikel dann – wie bei einem Klettverschluss – zusammenhalten", so Studienautor Michael Reithofer. Die Peptide sind dabei aufgrund ihrer eigenen funktionalen Gruppen und molekularen Struktur zur Selbstorganisation fähig.
Um die mit Peptiden funktionalisierten Teilchen zu organisieren, nutzen die Forscher*innen die Methode der sogenannten verdampfungsinduzierten Selbstorganisation: Im Zuge der Verdampfung eines Lösungsmittels, in dem sich die Peptide und die Partikel befinden, erfolgt die Selbstorganisation. Über die Wahl der Peptide und das Lösungsmittel kann die Form des Endproduktes maßgeblich beeinflusst werden.
Die Studie entstand in enger Kooperation mit Forscher*innen des NMR-Zentrums der Fakultät für Chemie: Über die NMR-Spektroskopie gelang es, Einblicke über die zugrundeliegenden Mechanismen der durch die Peptide angestoßene Selbstorganisation zu erhalten. "Wir stehen hier erst am Anfang, aber unsere Methode öffnet eine Tür, eine große Anzahl an verschiedenen Materialien zu designen – auch im Hinblick auf verschiedenste Anwendung wie etwa Wirkstofftransportsysteme oder neuartiger Nanokatalysatoren", so die Forscher.
Publikation in "Angewandte Chemie":
Evaporation-Induced Self-Assembly of Small Peptide-Conjugated Silica Nanoparticles, Cornelia von Baeckmann, Guilherme M. D. M. Rubio, Hanspeter Kählig, Dennis Kurzbach, Michael R. Reithofer, und Freddy Kleitz: Angewandte Chemie 2021, DOI:10.1002/anie.202108378
Wissenschaftlicher Kontakt
Univ.-Prof. Dr. Freddy Kleitz
Institut für Anorganische Chemie – Funktionelle MaterialienUniversität Wien
1090 - Wien, Währinger Straße 42
+43-1-4277-52902
freddy.kleitz@univie.ac.at
Rückfragehinweis
Pia Gärtner, MA
Pressebüro der Universität WienUniversität Wien
1010 - Wien, Universitätsring 1
+43-1-4277-17541
pia.gaertner@univie.ac.at
Downloads:
peptide.jpg
Dateigröße: 267,05 KB
