Ketone umweltfreundlich erzeugen
27. Mai 2019ChemikerInnen der Universität Wien entwickeln neue Synthesemethode
Neue Methoden zu finden bildet in der organischen Synthese die Grundlage für Fortschritte in der pharmazeutischen Wirkstoffentwicklung, der Materialwissenschaft sowie der chemischen Biologie und spielt somit eine zentrale Rolle in unserem Alltag. Einem Forschungsteam der Fakultät für Chemie an der Universität Wien gelang nun die Entwicklung einer neuen Methode zur Synthese von Ketonen. Die Ergebnisse daraus wurden kürzlich im Journal "Nature Communications" veröffentlicht.
Ketone sind entscheidende Moleküle in der Chemie. Der Name mag an Dinge wie die "ketogene Diät" erinnern, in der Ketone als Energiequelle in der Leber aus gespeichertem Fett hergestellt werden. Aber dies ist kein Forschungsergebnis zu Ernährung, sondern zu Methoden mit denen diese Ketone hergestellt werden. Ketone zeichnen sich durch ihre sogenannte Carbonylgruppe aus. Die Carbonylgruppe enthält immer eine charakteristische Kohlenstoff-Sauerstoff (also C-O) Doppelbindung und ist eine der fundamentalen Funktionalitäten in den Molekülen unserer Welt.
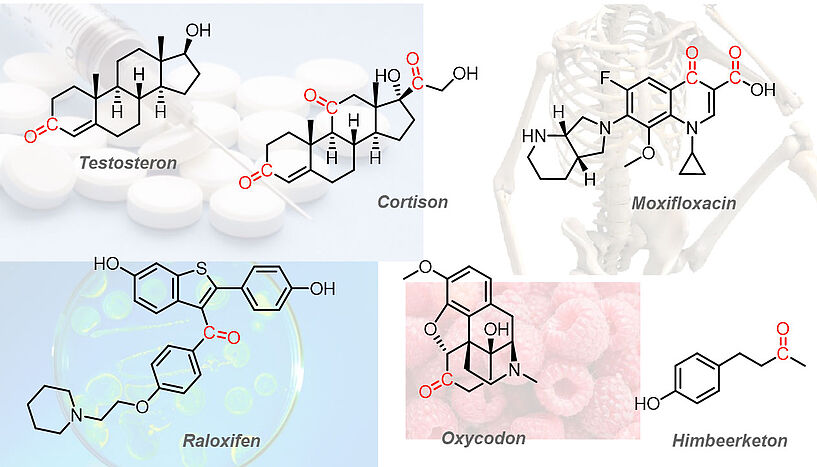
Man findet Ketone in verschiedensten Varianten. Teilweise in unserem Körper wie zum Beispiel in Testosteron und Cortison; oder auch in Wirkstoffen wie im Antibiotikum Moxifloxacin, im Opioid Oxycodon oder im Raloxifen, ein Östrogen-Modulator, welcher u.a. für die Behandlug von Osteoporose verwendet wird. Selbst das sogennante "Himbeerketon" welches in Himbeeren enthalten und für den typischen Geruch der Früchte verantwortlich ist, enthält eine Carbonylgruppe (Abb 1).
Eine anspruchsvolle Synthese
Alle obengenannten Ketone werden durch Syntheseverfahren produziert – häufig in riesigen Mengen. Die Synthese ist dabei allerdings nicht immer problemfrei. Klassicherweise werden für die Ketonsynthese Reaktionen eingesetzt, die unter anderem gefährliche, pyrophore Reagenzien verwenden und zu einer Menge Abfallprodukte führen, die abgetrennt und entsorgt werden müssen.
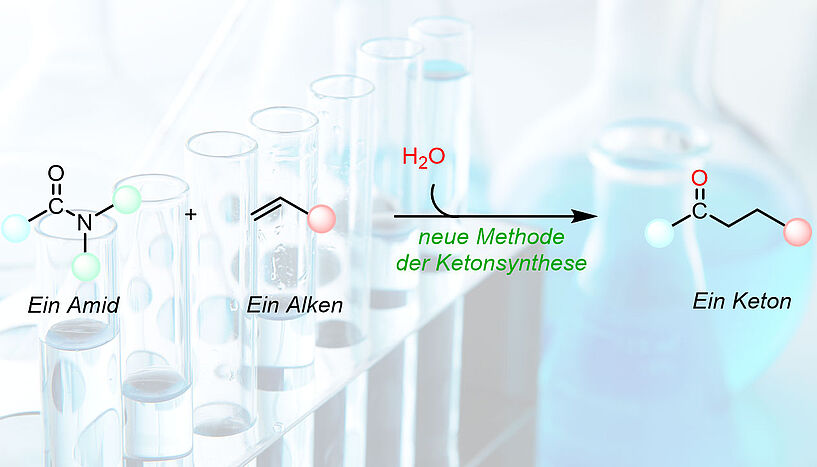
"Die ideale chemische Reaktion zur Herstellung von Ketonen würde von einfachen Startmaterialien ausgehen und nur minimalen Abfall erzeugen", sagt Dr. Jing Li, Erstautor der Studie. "Solch eine Reaktion existiert bereits: Die Hydroacylierung," erklärt der Postdoc.
Bei der Hydroacylierung reagiert ein Aldehyd (auch eine Verbindung mit einer Carbonylgruppe, aber mit einem Wasserstoffsubstituenten) mit einem Alkenen (typischerweise billige Startmaterialien aus der Familie der Kohlenwasserstoffe mit einer oder mehreren Kohlenstoff-Kohlenstoff-Doppelbindungen). "Der Nachteil der Hydroacylierung ist, dass sie immer einen teuren Übergangsmetallkatalysator benötigt wie beispielsweise Rhodium, ein seltenes und kostspieliges Metall", erklärt Rik Oost, Co-Autor der Arbeit. "Außerdem ist die Reaktion ziemlich kompliziert und oft begleitet von unerwünschten Nebenreaktionen, was dazu führt, dass die Auswahl an Ketonen, die mithilfe der Hydroacylierung herstellbar sind, ziemlich begrenzt ist", so Oost.
Hydroacylation neu erfinden
Die Gruppe um Nuno Maulide hat nun eine Alternative zur konventionellen Hydroacylierung entwickelt, die weder kostspielige Metalle benötigt noch die obengenannten Nebenreaktionen ausweist. "Wir haben die Spielregeln der Hydroacylierung komplett umgedreht", so Nuno Maulide, Professor für organische Synthese an der Universität Wien.
Die ForscherInnen verwendeten hierfür eine andere Art der Carbonylverbindung als Ausgangsstoff: stabile und robuste Carboxylamide. "Seit einigen Jahren forschen wir schon an der selektiven Aktivierung von Amiden", erklärt Maulide. "Nun haben wir einen Weg gefunden sie mit Alkenen reagieren zu lassen als seien sie Aldehyde. Das Ergebnis ist eine neue Form der Hydroacylierung", so der Wissenschafter des Jahres 2018.
"Durch diese neuentwickelte Reaktion kann man an die Ketonsynthese völlig neu herangehen. Bis jetzt gab es keine Möglichkeit bestimmte Ketone mittels Hydroacylierung herzustellen, beispielsweise mit anderen reaktiven Gruppen im selben Molekül, aufgrund von Limitierungen der ursprünglichen Reaktion. Mit unser neuen Methode können wir sogar eingesetzte Wirkstoffe und Pharmazeutika mit einer Amidgruppe selektiv modifizieren. Das eröffnet uns ganz neue Möglichkeiten für die Synthese von Feinchemikalien", freut sich Maulide.
Ein kniffeliger Mechanismus und der Wert der Zusammenarbeit
"Mechanistisch gesehen weist diese untypische Reaktion einige komplexe Umlagerungen auf", erklärt Leticia González, Professor für theoretische Chemie an der Universität Wien. Mithilfe von computergestützten Berechnungen gelang es den ForscherInnen die elementaren Schritte dieser neuen Reaktion zu verstehen. "Ein besonders interessanter Schritt ist der sogenannte Hydridtransfer, indem ein Wasserstoffatom zu einem entfernten Teil des Moleküls wandert und dabei zwei Elektronen mitnimmt", erklärt Boris Maryasin, ebenfalls vom Institut für theoretische Chemie und Co-Autor der Arbeit. "Diese und andere Details werden uns durch theoretisches Modelling der Reaktion zugänglich".
Das Zusammenspiel zwischen experimenteller organischer Chemie und theoretischer Chemie erlaubt es den WissenschafterInnen sich ein genaues Bild davon zu machen, was während der Reaktion geschieht. "Dies ist der wahre Wert der Teamarbeit. Allein wäre es uns nicht möglich gewesen, den Mechanismus der Reaktion zweifelsfrei aufzuklären, unsere KollegInnen der theoretischen Chemie hätten alleine keinen Zugang zu experimentellen Ergebnissen aus dem Labor gehabt. Das ist der Schlüssel für wissenschaftliche Zusammenarbeit, wo das Ganze mehr als die Summe der Einzelteile ergibt", so Maulide abschließend.
Publikation in "Nature Communications"
"A Redox-Neutral Synthesis of Ketones by Coupling of Alkenes and Amides”: Jing Li, Rik Oost, Boris Maryasin, Leticia González, Nuno Maulide
DOI: 10.1038/s41467-019-10151-x
Wissenschaftlicher Kontakt
Univ.-Prof. Dr. Nuno Maulide
Institut für Organische ChemieUniversität Wien
1090 - Wien, Währinger Straße 38
T +43-1-4277-521 55
M +43-664-60277-521 55
nuno.maulide@univie.ac.at
Rückfragehinweis
Paulina Parvanov, BA MA
PressebüroUniversität Wien
1010 - Wien, Universitätsring 1
+43-1-4277-175 40
+43-664-60277-175 40
paulina.parvanov@univie.ac.at
Downloads:
Ketonsynthese_Abb1_WEB.jpg
Dateigröße: 115,29 KB
Ketonsynthese_Abb2_WEB.jpg
Dateigröße: 83,05 KB