Chirale Moleküle: Gleich und doch verschieden
08. März 2016Neue Methode ermöglicht selektiv hergestellte Moleküle zur Arzneimittelgewinnung
Bei der Herstellung von so genannten chiralen Molekülen beschreiten Chemiker der Universität Wien um Nuno Maulide neue Wege. Chirale Moleküle liegen in zwei spiegelbildlichen Formen vor, die sich nicht vollständig decken und sich daher zueinander wie unsere linke und rechte Hand verhalten. Obwohl sie strukturell ident sind, kann es sein, dass eine dieser Formen nach Minze, die andere aber nach Kümmel riecht. Zur Gewinnung von neuen Arzneistoffen versucht Nuno Maulide gezielt, nur eine Form selektiv herzustellen. Eine neue Methode könnte nun den Durchbruch bringen. Die Studie erscheint aktuell in der renommierten Zeitschrift "Angewandte Chemie".
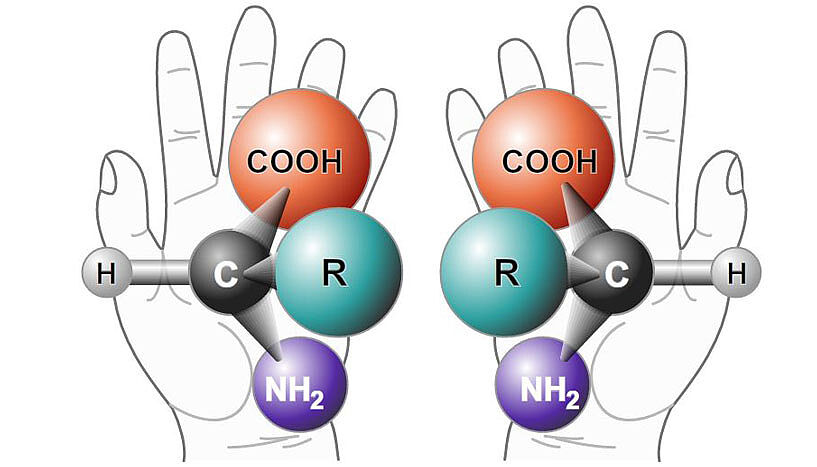
Symmetrie spielt eine fundamentale Rolle in unserer Welt. Unsere Augen empfinden symmetrische Gebäude und Konstruktionen als ästhetisch ansprechend und sogar der menschliche Körper ist – zumindest im Prinzip – symmetrisch. Dennoch sind bestimmte Objekte und Gegenstände aus unserem Alltag an sich unsymmetrisch, wie etwa ein Schneckenhaus oder unsere eigenen Hände und Füße. Diese Objekte lassen sich nicht mit ihrem eigenen Spiegelbild zur Deckung bringen – als ob man versucht, die rechte Hand einer Person mit der eigenen linken Hand zu schütteln.
In der Welt der Moleküle ist es nicht anders. Während viele Moleküle eine symmetrische Struktur aufweisen, besitzen manche von ihnen eine ähnliche Eigenschaft, vergleichbar mit der unserer Hände: Sie können in zwei spiegelbildlichen Formen vorliegen, welche nicht miteinander zur Deckung gebracht werden können und sich daher zueinander wie unsere linke und rechte Hand verhalten. Solche Moleküle werden als "chiral" bezeichnet (griechisch "chiros": Hand). Sie sind generell sehr wertvolle Substanzen mit zahlreichen speziellen Anwendungen, insbesondere in der Medizin. Diese Eigenschaften zu erforschen ist der Schwerpunkt von Nuno Maulide, Professor für organische Synthese an der Universität Wien.
"Das Faszinierende daran ist, wie dramatisch sich die beiden Formen in ihren Eigenschaften unterscheiden können", sagt Maulide, der 2013 mit seinem multinationalen Forschungsteam an die Universität Wien kam. "Das chirale Molekül Carvon kann zum Beispiel in zwei Formen vorliegen und jedes ist an sich eine eigene definierte Verbindung. Sie sind strukturell in jeder Hinsicht ident, bis auf die Tatsache, dass sie nicht zur Deckung zu bringende Spiegelbilder voneinander sind. Und eine dieser Formen riecht nach Minze, während die andere nach Kümmel riecht. Unser Körper ist in der Lage, diesen subtilen Strukturunterschied in bemerkenswerter Weise zu erkennen“, erklärt der Chemiker.
Wenn die Herausforderung im Spiegel zu finden ist
Maulides Gruppe arbeitet seit mehreren Jahren an der Entdeckung von Reaktionen, welche die Herstellung solcher Moleküle in nur einer einzigen "Händigkeit" erlauben. Dieses Arbeitsgebiet der Chemie wird als asymmetrische Synthese bezeichnet. "Für praktische Anwendungen z.B. in der Medizin ist es von enormer Bedeutung, nur eine Form dieser chiralen Moleküle selektiv herzustellen: Denn bei einem chiralen Arzneistoff ist gewöhnlich nur eine der beiden Formen der aktive Wirkstoff", so Maulide.
Ein tragisches Beispiel, welche katastrophale Auswirkung die Wirkweise eines chiralen Moleküls haben kann, ist Contergan, ein Beruhigungsmittel aus den 1950er Jahren. Der aktive Wirkstoff, ein chirales Molekül namens Thalidomid, wurde als Gemisch mit gleichem Anteil an beiden spiegelbildlichen Formen des Moleküls als Medikament eingesetzt. Während eine davon tatsächlich der Arzneistoff mit der beabsichtigten Wirkung war, wurde die andere Form für inaktiv gehalten – diese hatte jedoch einen fruchtschädigenden Effekt auf schwangere Frauen. "Das Beispiel Contergan zeigt, wie wichtig es ist, solche Stoffe in 100-prozentiger Reinheit und damit nur eine der spiegelbildlichen Formen herzustellen", betont der portugiesische Forscher.
Versuchen, was zuvor niemand versucht hat
Die meisten chemischen Reaktionen werden durch ein Prinzip analog zu dem elektrischer Ladungen vorangetrieben: Chemiker versuchen üblicherweise, positiv geladene Reagenzien mit einem negativ geladenen Gegenstück zu kombinieren. Durch die Anziehung der Ladungen nähern sich solche Reagenzien gegenseitig an und vereinigen sich zu einem neutralen Produkt. "Bisher fokussierten ForscherInnen beim Versuch, chirale Moleküle herzustellen, meistens darauf, eine chirale Information an der positiv geladenen Komponente der Reaktion zu haben. Dazu gibt es schon hinlänglich Erfahrungen", erklärt Maulide.
Nun beschritten Nuno Maulide und sein niederländischer Doktorand Rik Oost einen neuen Weg zur Herstellung solcher Substanzen: Sie verfolgten die exakt entgegengesetzte Strategie. "Damit haben wir die oft zitierte Büchse der Pandora geöffnet: Wir können nun über vollkommen neue chirale Moleküle nachdenken, die noch nie hergestellt wurden – noch dazu auf einfacherem und direkterem Wege", so Maulide. Einige davon sind Arzneistoffe oder haben vielversprechende biologische Aktivität.
Publikation in "Angewandte Chemie"
Enantioconvergent Fukuyama Cross-Coupling of Racemic Benzylic Secondary Organozinc Reagents: Rik Oost and Nuno Maulide, Angewandte Chemie, online 4. März 2016.
DOI: 10.1002/anie201600597
http://onlinelibrary.wiley.com/doi/10.1002/anie.201600597/abstract
Am Youtube-Channel "Chemie ist in" erklärt Nuno Maulide die faszinierende Welt der Chemie: Chemie ist in
Wissenschaftlicher Kontakt
Univ.-Prof. Dr. Nuno Maulide
Institut für Organische ChemieUniversität Wien
1090 - Wien, Währinger Straße 38
T +43-1-4277-521 55
M +43-664-60277-521 55
nuno.maulide@univie.ac.at
Rückfragehinweis
Mag. Alexandra Frey
Media Relations ManagerUniversität Wien
1010 - Wien, Universitätsring 1
+43-1-4277-17533
+43-664-8175675
alexandra.frey@univie.ac.at
Downloads:
Chiralitaet.JPG
Dateigröße: 51,55 KB
Forschung_Chemie_Nuno_Maulide_univie_01.jpg
Dateigröße: 3,29 MB