Die Neuronenwolken lichten sich
09. September 2013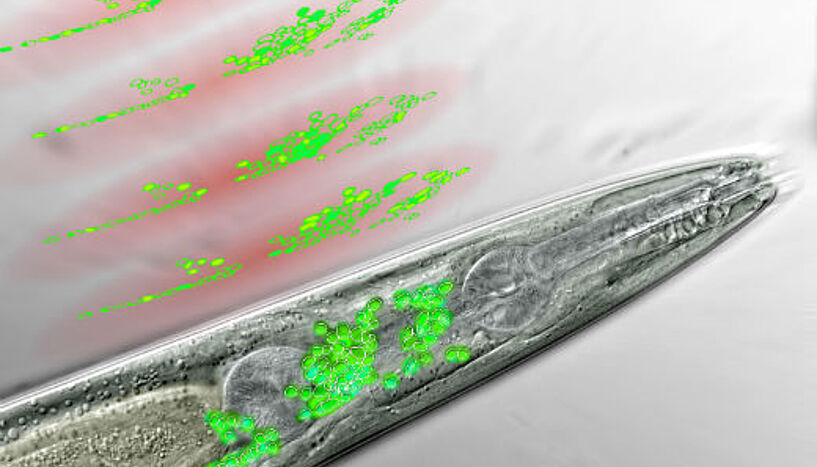
Kopfbereich des Fadenwurms unter dem Mikroskop, die Neuronen des "Gehirns" sind grün eingefärbt. Darüber sind die Lichtscheiben des WF-TeFo Mikroskops angedeutet, wie sie den Bereich des Gehirns abscannen und dabei die Aktivität verschiedener Neuronen abbilden (künstlerische Darstellung) (Copyright: IMP)
Utl: ForscherInnen entwickeln neue Mikroskopietechnik für die Neurowissenschaften WissenschafterInnen am Campus Vienna Biocenter um Alipasha Vaziri und Manuel Zimmer liefern technologische Neuerungen und wichtige Erkenntnisse auf dem Gebiet der Neurowissenschaften, die der Erforschung neuronaler Schaltkreise dienen. Dabei gingen physikalisches und molekularbiologisches Know-how Hand in Hand. Die Ergebnisse wurden in der aktuellen Ausgabe des Fachjournals "Nature Methods" publiziert.
Das Nervensystem des Fadenwurms C. elegans besteht aus lediglich 302 Nervenzellen (Neuronen). Das Besondere am Fadenwurm ist, dass seit über 25 Jahren bekannt ist, wie alle seine Neuronen genau miteinander verknüpft sind. Ein solch kompletter neuroanatomischer Atlas ist bisher für keinen anderen Organismus erhältlich. Zudem weiß man von einzelnen Neuronen, welche Reaktion – etwa bestimmte Bewegungsabläufe – sie im Wurm hervorrufen. Dennoch liegt für die Neurowissenschaften auch beim einfachsten Modellorganismus das Wichtigste noch im Dunkeln: Es fehlt ein funktionaler Atlas, der zeigt, wie ganze Neuronengruppen (neuronale Netzwerke) dynamisch miteinander interagieren. Nur mit diesem Wissen kann man ein Nervensystem als Ganzes verstehen. Dann könnte man auch noch bessere Rückschlüsse auf andere Organismen, wie etwa den Menschen, ziehen. Diese Lücke haben nun ForscherInnen am Forschungsinstitut für Molekulare Pathologie (IMP), an den Max F. Perutz Laboratories (MFPL) sowie an der Forschungsplattform "Quantum Phenomena & Nanoscale Biological Systems" (QuNaBioS) der Universität Wien mit einer neu entwickelten Methode geschlossen. Die neue Methode ist sowohl aus mikroskop-technischer als auch molekularbiologischer Sicht für die Forschung neu ist.
Zentrales Anliegen war die Entwicklung einer neuen Mikroskopietechnik, welche die Aktivität sehr vieler Neuronen rasch und gleichzeitig erfassen kann. "Normalerweise scannt das Objektiv eines Lichtmikroskops in allen drei Dimensionen. Das dauert viel zu lange, um die Aktivität aller Neuronen gleichzeitig aufnehmen zu können. Wir haben nun einen physikalischen Trick gefunden, die Form des zur Mikroskopie eingesetzten Lichtes gezielt zu gestalten, was wir 'Light Sculpting' nennen. Dadurch brauchen wir nur noch in einer Dimension zu scannen", erklärt der Physiker Robert Prevedel, Senior Postdoc im Labor von Alipasha Vaziri. IMP-MFPL Gruppenleiter und Leiter der QuNaBioS-Forschungsplattform der Universität Wien. Die neue Mikroskopiemethode wurde von Physikern dieser Forschungsplattform entwickelt. "Mit den so produzierten dreidimensionalen Videos beobachten wir, wie sich die gleichzeitige Aktivität vieler Neuronen über einen bestimmten Zeitraum verändert", sagt Prevedel.
Komplette neuronale Netzwerke im Blickfeld
Die neue Mikroskopietechnik war aber nur der halbe Weg zum Erfolg. Die Aktivität von Neuronen wird mit Hilfe von Kalziumsensoren gemessen. Ein bestimmtes zur Markierung verwendetes fluoreszierendes Protein leuchtet auf, wenn es Kalzium bindet. Sobald die Neuronen aktiviert werden, steigen die Kalziumkonzentration und damit auch die Intensität der Fluoreszenz an, die gemessen werden kann. Jedoch lagen die vielen Neuronen auf den Scanbildern so dicht aneinander, dass sie nicht voneinander zu unterscheiden waren. "Indem wir daraufhin den Kalziumsensor nur in den Zellkern anstatt in das gesamte Zellinnere gebracht haben, umgingen wir dieses Problem. So wurden die Umrisse einzelner Neuronen sichtbar, was deren Identifikation erlaubte", so Tina Schrödel, Neurobiologin und Doktorandin im Labor von Manuel Zimmer am IMP und Co-Erstautorin der Studie. "Mit dieser Methode erfassen wir gleichzeitig fast alle Neuronen im Gehirn des Wurms", so Schrödel weiter.
Vom Aktivitäts- zum Verhaltensmuster
Die ForscherInnen machen auf diese Weise Neuronengruppen aus, die bestimmte Aktivitätsmuster zeigen. Daraus lässt sich schließen, wie Information im gesamten Gehirn des Wurms verarbeitet wird. "Das große Ziel der Neurowissenschaften ist es, aus den Aktivitätsmustern von Neuronen abzuleiten, wie Organismen Sinnesreize verarbeiten, Entscheidungen treffen und dann reagieren. Die neue Methode, die nur durch enge Zusammenarbeit von PhysikerInnen und NeurobiologInnen entwickelt werden konnte, bringt die ForscherInnen diesem Ziel entscheidend näher. "Wir beginnen gerade, wichtige neue Erkenntnisse zu gewinnen, zu denen man vorher keinen experimentellen Zugang hatte. In den nächsten Schritten werden wir erforschen, wie unterschiedliche Reize im Gehirn verarbeitet werden" erklärt Schrödel. "Wir werden auch weiterhin neue Methoden dazu entwickeln. Wir wollen zum Beispiel wissen, wie bestimme Bewegungsabläufe im Gehirn geplant und ausgeführt werden. Dazu müssen wir sowohl die Mikroskopietechnik als auch die Datenanalyse verbessern, sodass wir dies auch bei frei beweglichen Würmern aufzeichnen können – das wird unser Ziel für die kommenden ein bis zwei Jahre sein", erklärt Prevedel abschließend.
Publikation in Nature Methods:
Tina Schrödel, Robert Prevedel, Karin Aumayr, Manuel Zimmer und Alipasha Vaziri: Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. In: Nature Methods (September 2013).
DOI:10.1038/nmeth.2637
Max F. Perutz Laboratories
Die Max F. Perutz Laboratories (MFPL) sind ein gemeinsames Forschungs- und Ausbildungszentrum der Universität Wien und der Medizinischen Universität Wien am Campus Vienna Biocenter. An den MFPL sind rund 530 WissenschafterInnen in über 60 Forschungsgruppen mit Grundlagenforschung im Bereich der Molekularbiologie beschäftigt.
Wissenschaftliche Kontakte
Ass. Prof. Dr. Alipasha Vaziri
Research Institute of Molecular Pathology (IMP)
Max F. Perutz Laboratories (MFPL) and Research Platform Quantum Phenomena & Nanoscale Biological Systems (QuNaBioS), Universität Wien
T +43-1-79730-3540
alipasha.vaziri(at)univie.ac.at
Dr. Manuel Zimmer
Gruppenleiter
Research Institute of Molecular Pathology (IMP)
T +43-1-79730-3430
manuel.zimmer(at)imp.ac.at
Rückfragehinweis
Dr. Lilly Sommer
Max F. Perutz Laboratories
Communications
T +43-1-4277-240 14
lilly.sommer(at)univie.ac.at
Wissenschaftlicher Kontakt
Ass. Prof. Dr. Alipasha Vaziri
Max F. Perutz Laboratories (MFPL) and Research Platform Quantum Phenomena & Nanoscale Biological Systems (QuNaBioS)Universität Wien
+43-1-79730-35 40
+43-664-60277-542 52
alipasha.vaziri@univie.ac.at
Rückfragehinweis
Dr. Lilly Sommer
Max F. Perutz Laboratories, CommunicationsUniversität Wien
1030 - Wien, Dr.-Bohr-Gasse 9
+43-1-4277-240 14
lilly.sommer@univie.ac.at
Downloads:
Vaziri_NatureMethods.jpg
Dateigröße: 751,05 KB
