Bisher unbekannte Funktion eines altbekannten Rezeptors entdeckt
11. August 2022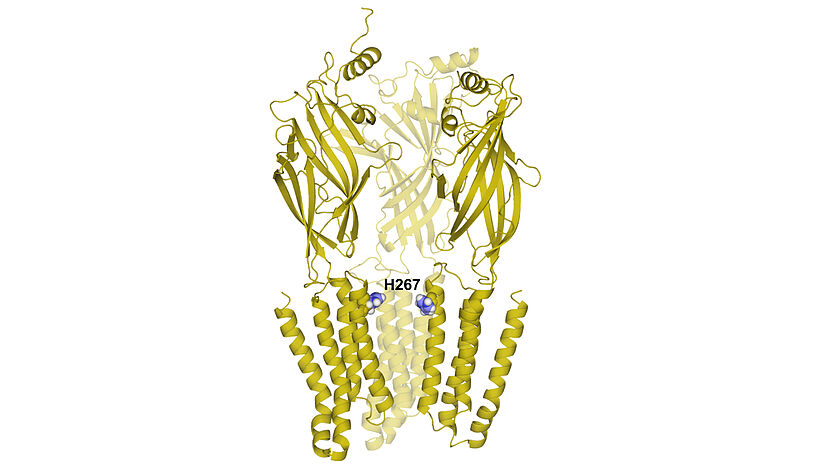
Abbildung 1: Kristallstruktur der Protonensensoren. Eine einzelne Aminosäure (Histidin in Position 267) spielt eine entscheidende Rolle bei Detektion von Veränderungen im pH Wert. (© Theres Friesacher und Aleksandra Garifulina basierend auf Miller et.al, 2014 DOI: 10.1038/NATURE13293)
Durch die Entdeckung vielfältiger Funktionen von Rezeptoren können Medikamente zielgerichteter entwickelt werden
GABAA Rezeptoren sind wichtige und weit verbreitete Angriffspunkte für hemmende Neurotransmitter im zentralen Nervensystem. Studierende des durch den FWF finanzierten, interdisziplinären Doktoratskollegs der Universität Wien "Molecular Drug Targets" (MolTag) haben eine neue Funktion dieser viel beforschten Membranproteine entdeckt. Bestimmte Untereinheiten von GABAA Rezeptoren bilden neben ihrer Funktion als Rezeptoren für den Neurotransmitter GABA auch einen Sensor für Protonen und reagieren so auf pH Veränderungen in der Umgebung. Die Studie ist aktuell in der Fachzeitschrift Communications Biology erschienen.
Am besten untersucht sind GABAA-Rezeptoren des zentralen Nervensystems, vor allem im Gehirn und Rückenmark. Hier erfüllen sie wichtige Funktionen, etwa bei der Initiierung und Aufrechterhaltung des Schlafzustands. Arzneistoffe, die auf GABAA Rezeptoren wirken, werden in der Anästhesie eingesetzt, fördern Schlaf, sind wirksam bei Epilepsie und können Angst lösen. Wissenschafter*innen der Universität Wien haben jetzt herausgefunden, dass Untereinheiten von GABAA Rezeptoren auch Protonensensoren bilden können. Ein besseres Verständnis der vielfältigen Funktionen dieser großen, für das Nervensystem bedeutsamen Rezeptorfamilie kann zu einer Entwicklung von zielgerichteteren und effizienteren Medikamenten beitragen.
Entdeckung durch interdisziplinäre Zusammenarbeit
Erste Hinweise auf die neue, bisher unbekannte Funktion der ß(Beta)-Untereinheiten von GABAA Rezeptoren fand MolTag-Absolvent Marco Stadler, der sich mit der Wirkung von pflanzlichen Naturstoffen auf GABAA Rezeptoren beschäftigte und dabei auch Veränderungen im pH-Wert berücksichtigte. Aleksandra Garifulina, die derzeit als MolTag-Doktorandin an der Charakterisierung dieser neuen pH-Sensoren arbeitet, konnte zeigen, dass alle bekannten ß-Untereinheiten der Rezeptoren derartige Kanäle bilden und dass sich diese schon bei geringen Änderungen in der Protonenkonzentration öffnen, was eine Funktion im Organismus nahelegt. Gemeinsam mit Theres Friesacher, einer Strukturbiologin des MolTag-Kollegs, konnte Aleksandra Garifulina den molekularen Mechanismus entschlüsseln. Ihre Computersimulationen zeigen, dass die Anlagerung von Protonen an ein Histidin in Position 267 am Öffnen und Schließen dieser Chloridkanäle beteiligt ist.
Mögliche Funktion für das Immunsystem
Die Gemeinschaftsarbeit der drei MolTag-Student*innen wurde in der Zeitschrift Communications Biology publiziert. Professor Steffen Hering vom Department für Pharmazeutische Wissenschaften, wissenschaftlicher Betreuer von Stadler und Garifulina, sagt: "Veränderungen im pH-Wert, also in der Protonenkonzentration im Gewebe, treten zum Beispiel bei Entzündungen und Sauerstoffmangel auf. Aleksandra und ihr Team haben sehr wahrscheinlich einen wichtigen, neuen Regulationsmechanismus bei pH-Verschiebungen im zentralen Nervensystem, aber auch vielen anderen Organen unseres Körpers entdeckt. Erste Ergebnisse weisen auf eine Bedeutung im Immunsystem hin. Bei der Klärung der Funktion dieser bislang unbekannten Ionenkanäle und ihrer möglichen Rolle als Angriffspunkt für neue Arzneistoffe, stehen wir erst am Anfang."
Originalpublikation:
Garifulina, A., Friesacher, T., Stadler, M. et al. β subunits of GABAA receptors form proton-gated chloride channels: Insights into the molecular basis. Commun Biol 5, 784 (2022).
DOI: https://doi.org/10.1038/s42003-022-03720-2
Abbildungen:
Abb. 1: Kristallstruktur der Protonensensoren. Eine einzelne Aminosäure (Histidin in Position 267) spielt eine entscheidende Rolle bei Detektion von Veränderungen im pH Wert. (© Theres Friesacher und Aleksandra Garifulina basierend auf Miller et.al, 2014 DOI: 10.1038/NATURE13293)
Wissenschaftlicher Kontakt
Univ.-Prof. Dr. Steffen Hering
Projektleiter des Doktoratskollegs "Molecular Drug Targets"Universität Wien
1090 - Wien, Althanstraße 14
+43-1-4277-553 10
steffen.hering@univie.ac.at
Rückfragehinweis
Theresa Bittermann
Media Relations, Universität Wien1010 - Wien, Universitätsring 1
+43-1-4277-17541
theresa.bittermann@univie.ac.at
Downloads:
20220812_Hering_GABAA_Abb1.jpg
Dateigröße: 883,19 KB
