Bakterien sorgen für Immunität gegen Riesenviren
29. August 2022Chlamydien schützen Einzeller vor tödlicher Virusinfektion
Amöben erhalten überraschende Unterstützung in der Virusabwehr: Bakterien, mit denen sie infiziert sind, bewahren sie davor, von Riesenviren zerstört zu werden. Forscher*innen unter der Leitung des Mikrobiologen Matthias Horn vom Zentrum für Mikrobiologie und Umweltsystemwissenschaft der Universität Wien haben untersucht, wie eine Virusinfektion abläuft, wenn die Amöben zugleich mit Chlamydien infiziert sind. Das Forschungsteam zeigt erstmals, dass als Symbionten bezeichnete intrazelluläre Bakterien ihren Wirt gegen Viren schützen. Amöben sind einzellige Mikroorganismen mit einem Zellkern, auch Protisten genannt. Protisten spielen als Nahrung kleiner Tiere eine zentrale Rolle in der Nahrungskette und für die Funktionsweise von Ökosystemen. Die Ergebnisse der Studie legen folglich nahe, dass die Interaktion zwischen Symbionten und Viren den Nährstofffluss in Ökosystemen beeinflusst. Die Studie erscheint nun in der internationalen Fachzeitschrift PNAS.
Intrazelluläre Bakterien: Freund statt Feind?
Unter natürlichen Bedingungen sind Protisten, zu denen auch die untersuchten Amöben gehören, häufig von Bakterien, unter anderem Chlamydien, infiziert. Chlamydien sind primär als Krankheitserreger des Menschen bekannt. Nahe Verwandte dieser humanpathogenen Chlamydien wurden mittlerweile jedoch in einer Vielzahl von Tieren und Einzellern entdeckt. "Da eine Chlamydien-Infektion nach aktuellem Wissensstand zu einem langsameren Wachstum des infizierten Wirts führt, gelten sie gemeinhin als Parasiten", erklärt Patrick Arthofer, Erstautor der Studie und Doktorand am Zentrum für Mikrobiologie und Umweltsystemwissenschaft der Universität Wien. Parasiten sind intrazelluläre Bakterien – also Symbionten – die einen negativen Einfluss auf den Wirt haben. Symbionten, die einen positiven Effekt haben, bezeichnet man als Mutualisten. "Unsere Studie zeigt nun, dass Chlamydien hier tatsächlich eher Mutualisten statt Parasiten sind, weil sie die Protisten gegen die für sie sonst tödliche Infektion durch Riesenviren schützen. Ein langsameres Wachstum ist schließlich besser als zu sterben", sagt Arthofer.
Riesenviren und ihre einzelligen Wirte
Infektionen mit Bakterien, aber auch jene mit Viren, prägen, wie sich die Populationen von Protisten entwickeln. Die Forscher*innen der Universität Wien und der Université de Poitiers in Frankreich wollten wissen, wie eine Virusinfektion abläuft, wenn Protisten gleichzeitig mit Bakterien infiziert sind. Um Konstellationen, wie sie in natürlichen Umgebungen vorkommen, nachzuzeichnen, isolierten die Wissenschafter*innen Amöben, Bakterien und einen Riesenvirus – die anderen zwei in der Studie berücksichtigten Viren sind Modellsysteme für Riesenviren – aus ein- und derselben Umweltprobe.
Riesenviren sind erst seit knapp 20 Jahren bekannt. Ihre Entdeckung hat viele, bisher gültige Annahmen über Viren, auf den Kopf gestellt, weil sie nicht nur um ein Vielfaches größer sind als alle bis dahin bekannten Viren, sondern auch über Gene verfügen, die bis dahin als charakteristisch für zelluläre Lebewesen wie Bakterien, Tiere, Pflanzen und Pilze galten. Nach heutigem Wissensstand sind sie völlig ungefährlich für Tiere und den Menschen. Ihre natürlichen Wirte sind Einzeller mit Zellkern, die Protisten. Wenn Riesenviren eine Wirtszelle infizieren, bauen sie die gesamte Wirtszelle um und errichten eine sogenannte "Virusfabrik". Diese produziert hunderte von neuen Viruspartikeln bis die Wirtszelle platzt und die neuen Viren freisetzt. "Wenn der Protist mit bakteriellen Symbionten infiziert ist, wird genau dieser Prozess unterbunden", erklärt Matthias Horn, Leiter der Forschungsgruppe. "Unsere Studie zeigt, dass das Vorhandensein der Chlamydien zwar nicht verhindert, dass das Virus aufgenommen wird. Die Viren können anschließend aber keine funktionstüchtige Virusfabrik bilden", erzählt er. Das, was in dieser Interaktion zwischen den Bakterien und den Riesenviren innerhalb der Amöbe passiert, hat nicht nur Folgen für den Wirt selbst. "Eine gängige Hypothese ist, dass diese intrazellulären Interaktionen zwischen Riesenviren und bakteriellen Symbionten eine Rolle dabei gespielt haben, dass Riesenviren so komplex geworden sind", sagt Horn. Die Untersuchung von Virus-Symbionten-Interaktionen könnte daher Antworten auf die Frage nach der Entstehung von Riesenviren bringen.
Bakterien, die vor Viren schützen, beeinflussen Nahrungsnetze
Protisten sind weit verbreitet und leben unter anderem in Gewässern, in Meerwasser und Meeresböden. Sie ernähren sich von Bakterien, nehmen damit die in den Bakterien gebundenen Nährstoffe auf und geben diese, wenn sie selbst gefressen werden, an Tiere wie kleine Krebse weiter. Nur auf diesem Wege haben die Tiere auf die Nährstoffe der Bakterien Zugriff. Werden die Protisten von Viren getötet, können die dabei freigesetzten Nährstoffe nur wieder von Bakterien verwertet werden. "Wenn Chlamydien die Protisten davor schützen, von Viren zerstört zu werden, sorgen sie damit also nicht bloß dafür, dass ihre Wirte als Nahrungsquelle für kleine Tiere erhalten bleiben. Die bakteriellen Symbionten könnten auf diese Weise den gesamten Nährstoffzyklus in Ökosystemen beeinflussen", erklärt Arthofer.
Zukünftige Forschung soll zeigen, inwieweit dieser Prozess für die Funktionsweise von Ökosystemen von Bedeutung ist. "Der genauere Blick auf die Viren-Symbionten-Interaktion verrät uns grundsätzlich etwas über Dynamiken im Ökosystem", betont Matthias Horn. Die Wissenschafter*innen wollen daher als nächstes auch den genauen Mechanismus untersuchen, der hinter dem Bakterien-vermittelten Schutz von Protisten vor Riesenviren steht. Anouk Willemsen, Co-Autorin des Papers und Virologin am Zentrum für Mikrobiologie und Umweltsystemwissenschaft der Universität Wien, wiederum richtet ihren Blick ganz spezifisch auf die Riesenviren: In einem erst kürzlich vom Europäischen Forschungsrats (European Research Council, ERC) bewilligten Forschungsprojekt untersucht sie, wie Riesenviren ihre Komplexität erlangt haben.
Originalpublikation:
Patrick Arthofer, Vincent Delafont, Anouk Willemsen, Florian Panhölzl, Matthias Horn: Defensive symbiosis against giant viruses in amoebae. In: Proceedings of the National Academy of Sciences (PNAS), 2022.
DOI: 10.1073/pnas.2205856119
Abbildungen:
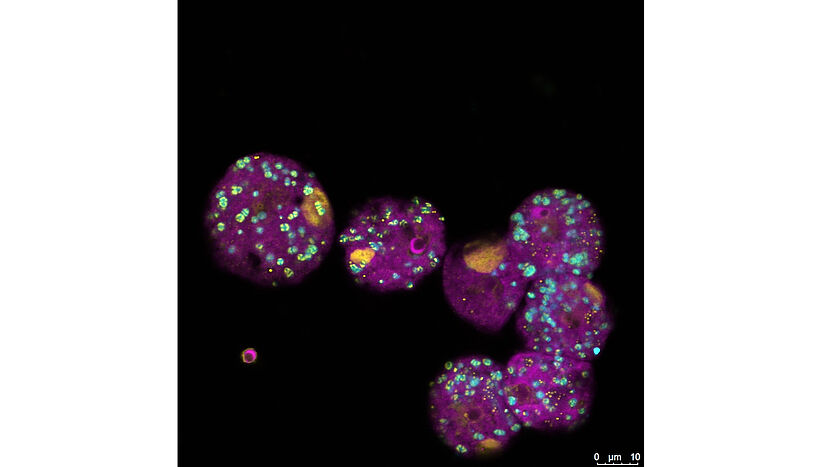
Abb. 1: Die FISH-Aufnahme – FISH steht für ein Visualisierungsverfahren namens Fluoreszenz-in-situ-Hybridisierung – zeigt Amöben, die gleichzeitig mit dem Viennavirus und dem bakteriellen Symbionten infiziert sind. Die Amöben sind im Bild magenta, ihre Symbionten cyan und DNA ist gelb dargestellt. Die größeren gelben Strukturen sind die Virusfabriken, die hier allerdings noch in der Anfangsphase sind und keine infektiösen Viren produzieren können. © Patrick Arthofer
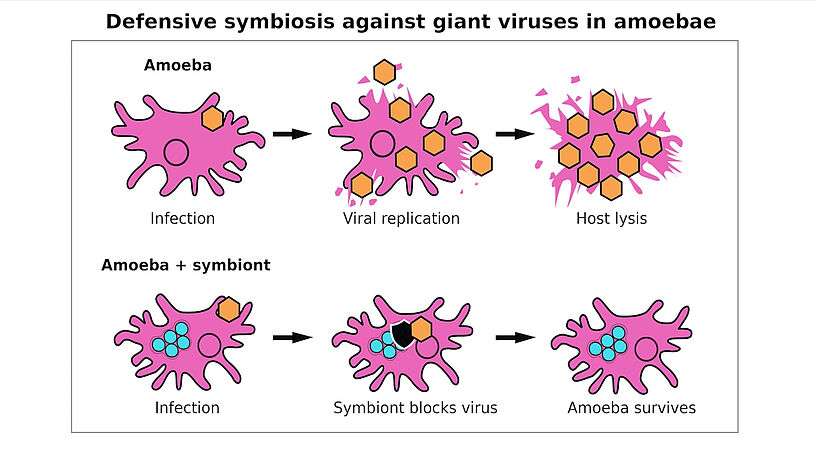
Abb. 2: Graphical Abstract zur Studie: Es zeigt, wie es in der Amöbe durch eine Riesenvirusinfektion (orangefarbenes Sechseck) zur Produktion von Virusteilchen kommt, bis die Wirtszelle zerplatzt und dadurch stirbt. Wenn die Amöbe mit einem bakteriellen Symbionten infiziert ist (türkise Kreise), kann das Virus zwar in die Amöbe eindringen, der Symbiont blockt es jedoch und die Amöbe überlebt. © Patrick Arthofer
Abb. 3: Patrick Arthofer während einer lichtmikroskopischen Untersuchung einer Amöbenkultur. © Universität Wien
Wissenschaftlicher Kontakt
Univ.-Prof. Dr. Matthias Horn
Zentrum für Mikrobiologie und UmweltsystemwissenschaftUniversität Wien
1090 - Wien, Althanstraße 14
+43-1-4277-543 93
http://cmess.csb.univie.ac.at
matthias.horn@univie.ac.at
Patrick Arthofer
Department für Mikrobiologie und Ökosystemforschung1030 - Wien, Djerassiplatz 1
+43 1 4277 91221
patrick.arthofer@univie.ac.at
Rückfragehinweis
Dr. Pamela Nölleke-Przybylski
Büro des Zentrums für Mikrobiologie und Umweltsystemwissenschaft1030 - Wien, Djerassiplatz 1
+43-1-4277-91103
pamela.noelleke@univie.ac.at
Downloads:
20220829_ArthoferHorn_Abb1.jpg
Dateigröße: 496,31 KB
20220829_ArthoferHorn_Abb2.jpg
Dateigröße: 1,12 MB
20220829_ArthoferHorn_Abb3.jpg
Dateigröße: 425,6 KB