Wenn Bakterien zellulären Selbstmord verhindern
| 18. Mai 2012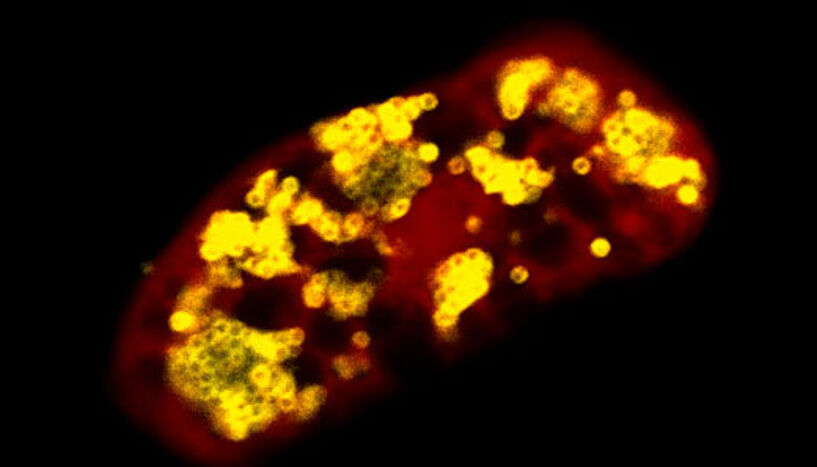
Fluoreszenzbild einer mit Umweltchlamydien infizierten Amöbe (Bakterien: gelb, Amöbe: rot).
Chlamydien kennt man als Erreger, die u.a. Augen- oder Geschlechtskrankheiten hervorrufen. Ihre nächsten Verwandten, die Umweltchlamydien, sind harmlos. Warum eine Chlamydiengruppe Mensch und Tier gefährdet und die andere nicht, untersuchen die MikrobiologInnen Barbara Sixt und Matthias Horn.
Chlamydien sind Bakterien, die ein bedeutendes Merkmal gemeinsam haben: Sie brauchen eine Wirtszelle, um sich in ihrem Inneren vermehren zu können. "Im Gegensatz zu den pathogenen Chlamydien wissen wir über ihre nächsten Verwandten – symbiontische Bakterien, die in einzelligen Amöben leben und in der Umwelt, beispielsweise im Trinkwasser, zu finden sind – noch vergleichsweise wenig", erklärt Matthias Horn vom Department für Mikrobielle Ökologie: "Dass es diese Umweltchlamydien gibt, ist überhaupt erst seit gut zehn Jahren bekannt."
Obwohl noch ein sehr junges Forschungsfeld, ist das Team um Matthias Horn schon länger sehr erfolgreich dabei, die Rätsel der "chlamydialen Mikrowelt" zu lösen. Eines davon lautet: Warum verursachen humanpathogene Chlamydien bei mehrzelligen Lebewesen schwere Krankheiten, die ihnen sehr ähnliche Bakteriengruppe der Umweltchlamydien aber nicht? Erste wichtige Antworten auf diese Frage publizierten die WissenschafterInnen um Matthias Horn – Erstautorin ist die Praedoc-Mitarbeiterin Barbara Sixt – vor kurzem im Journal PLoS ONE.
Pathogene Chlamydien können es, Umweltchlamydien nicht
Dass pathogene Chlamydien gefährliche Krankheitserreger sind – wie beispielsweise im Fall der in Entwicklungsländern verbreiteten Augenentzündung Trachom, die zu Erblindung führen kann –, ist von ihrer Fähigkeit abhängig, eine Form des programmierten Zelltods (Apoptose) in ihrer Wirtszelle zu hemmen (inhibieren). "Symbiontische Chlamydien können das nicht und haben daher keine Chance, sich zu vermehren, wie wir in Experimenten mit Zellkulturen von Insekten nachweisen konnten", fassen die ForscherInnen die Ergebnisse zusammen.
Die Wirtszelle als Untertan
"Das zelluläre Selbstmordprogramm ist ein wichtiger Schutzmechanismus mehrzelliger Organismen, den nur die 'klassischen' Chlamydien auszuhebeln wissen. Beide Bakteriengruppen bauen sich ihren intrazellulären Lebensraum: Sie injizieren Proteine und 'bedienen' sich der Stoffwechselprodukte der Wirtszelle", erklärt Barbara Sixt: "Um einen vielzelligen Wirt befallen zu können, müssten die Umweltchlamydien aber auch lernen, die Apoptose zu inhibieren."
 | Dieser Artikel erschien im Forschungsnewsletter Mai 2012 Lesen Sie auch: > "Himalayaforschung: Grenzüberschreitendes Initiativkolleg" > "Risikoforschung: Wenn der Hang rutscht" |
|---|
Für das Leben mit einzelligen Amöben, dem bevorzugten Wirt der symbiontischen Bakterien, brauchen sie diese Fähigkeit nicht. "Von diesen asexuellen Einzellern kennt man kein zelluläres Selbstmordprogramm", berichtet die Mikrobiologin, der die Begeisterung für das Forschungsfeld anzusehen ist. Die Interaktion zwischen den Bakterien und ihren Wirtszellen untersucht die Nachwuchswissenschafterin im Rahmen ihrer Dissertation, gefördert durch das ÖAW-Stipendium DOC-fFORTE.
Die Forschungsarbeit der Mikrobiologin Sixt findet großteils im Labor statt und dreht sich aktuell um die relativ "pflegeleichten" Zellkulturen von Insekten sowie jene von Säugetieren, die sich bei 37 Grad Celsius und einer besonderen Gasatmosphäre in einem Brutschrank befinden.
Mit tierischen Zellen im Labor
Im Experiment infizierte die Mikrobiologin Insektenzellkulturen zum einen mit Umweltchlamydien – "gewonnen" aus Amöben – und zum anderen mit einer Bakteriengruppe, die sich auch im Menschen vermehren kann. Sie untersuchte, wie gut sie in die Wirtszelle eindringen und sich vermehren. Darüber hinaus konzentrierte sie sich auf Merkmale, die auf das Zelltodprogramm hinweisen: u.a. die Verdichtung der DNA im Zellkern, das allgemeine Schrumpfen der Zelle, die Fragmentierung des Kerns und die Aktivität bestimmter Enzyme.
"Eine bestimmte Gruppe von Enzymen, sogenannte Caspasen, sind besonders wichtig für die Apoptose. Wir haben ihre Aktivität künstlich gehemmt, d.h. das Selbstmordprogramm ausgeschaltet, und konnten beobachten, dass sich dann auch jene Chlamydien sehr effektiv vermehren, die normalerweise nur Amöben infizieren", erzählt Sixt von den Ergebnissen. Ob sich diese Vorgänge auch in Zellkulturen von Säugern wiederholen, erforscht das motivierte Team aktuell im Rahmen weiterer Experimente. Neue Erkenntnisse darüber, was harmlose von krankheitserregenden Chlamydien unterscheidet – eine Infektion kann unbehandelt u.a. Unfruchtbarkeit und Atemwegserkrankungen zur Folge haben –, werden auf längere Sicht auch zur gezielten Weiterentwicklung von Medikamenten beitragen können. (dh)
Zum Nachhören: Am Freitag, 18. Mai, sprachen Matthias Horn und Barbara Sixt auf Ö1 in "Dimensionen - die Welt der Wissenschaft" über "Warum machen nicht alle Chlamydien-Arten krank?"
Univ.-Prof. Dr. Matthias Horn vom Department für Mikrobielle Ökologie erhielt im Juli 2011 den prestigeträchtigen ERC Starting Grant des Europäischen Forschungsrates: Das Forschungsvorhaben wird auf fünf Jahre mit rund 1,5 Millionen Euro finanziert. Mag. Barbara Susanne Sixt ist Mitarbeiterin der Forschungsgruppe und arbeitet derzeit an ihrer Dissertation.
Das Paper "Lack of Effective Anti-Apoptotic Activities Restricts Growth of Parachlamydiaceae in Insect Cells" (AutorInnen: Barbara S. Sixt, Birgit Hiess, Lena König, Matthias Horn) erschien im Jänner 2012 in der Fachzeitschrift PLoS ONE.


