Prozessoptimierung in der Zelle
| 23. September 2015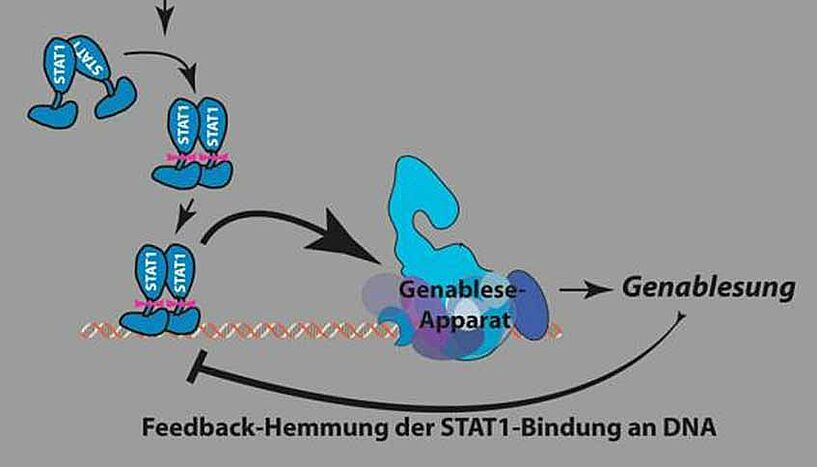
Cleverer Rückkopplungsmechanismus reguliert Immunantworten. (Foto: Pavel Kovarik)
Dass Immunantworten nicht aus dem Ruder laufen, ist einem neu entdeckten Rückkoppelungsmechanismus des Körpers zu verdanken. Herausgefunden hat dies ein Team rund um Immunbiologen Pavel Kovarik von der Universität Wien in einem aktuellen FWF-Projekt.
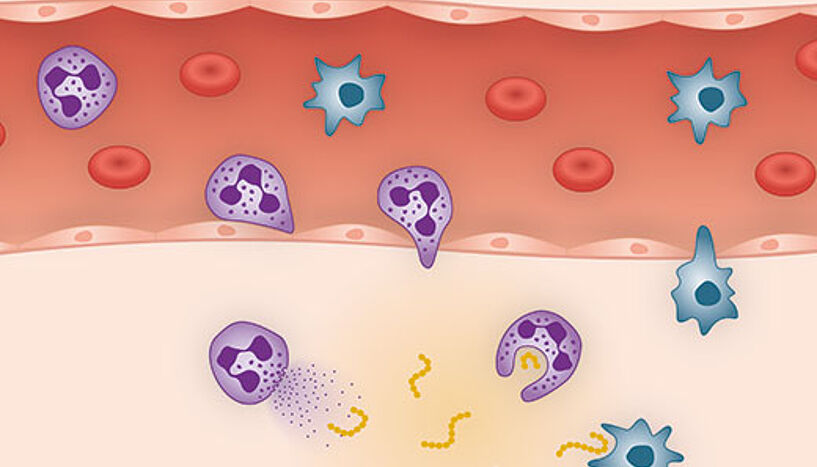
Dringen Mikroorganismen in den Körper ein, werden Zytokine – Proteine, die das Verhalten von Zellen beeinflussen – freigesetzt, die sofort Abwehrmaßnahmen initiieren. Diese bestehen auch im Aktivieren und Ablesen bestimmter Gene und damit in der Produktion von Abwehrproteinen. Dabei ist es wichtig, dass der Körper nicht zu viele dieser Proteine produziert, denn das würde den eigenen Körper schädigen. Daher wird deren Herstellung rechtzeitig gedrosselt. Dass dies passiert, ist seit Langem bekannt. Wie es passiert, ist erst seit Kurzem – dank der Team-Arbeit rund um Pavel Kovarik vom Department für Mikrobiologie, Immunbiologie und Genetik –, bekannt.
Verblüffend wirksamer Mechanismus
Zum besseren Verständnis des soeben entschlüsselten Mechanismus ist es wichtig zu wissen, dass Zytokine auf die sogenannte STAT-Familie von Proteinen wirken, die als Transkriptionsfaktoren agieren – also als Faktoren, die an der DNA das Ablesen von Genen und damit die Produktion von Proteinen initiieren. Zur Erfüllung dieser Funktion müssen die STATs an spezielle Sequenzen der DNA binden, und es ist genau diese Bindung, die durch Zytokine gefördert wird. Bei seiner Arbeit konzentrierte sich das Team um Kovarik zunächst auf das gegen virale Infektionen produzierte Zytokin Interferon und die Regulation der Aktivität von STAT1.
Die Untersuchungen führten zur Entdeckung eines neuen und verblüffend wirksamen Mechanismus. Das Team konnte zeigen, dass mit Fortschreiten des von STAT1 initiierten Ablesens eines Gens STAT1 zunehmend von der DNA gelöst wird. Kovarik dazu: "Dieser bisher unbekannte Feedback-Mechanismus setzt sehr frühzeitig im Prozess der Herstellung von Abwehrproteinen an und erlaubt somit eine rasche Regulierung einer Immunantwort." In der Folge konnte das Projekt-Team den gleichen Regulierungsvorgang auch für STAT2 und STAT3 beobachten, was ein Hinweis auf die evolutionär frühzeitige Verbreitung dieses Mechanismus ist.
Klares Ergebnis
In der Folge konnte Pavel Kovarik auch zeigen, dass ein anderer – bereits bekannter – Prozess der Inaktivierung von STAT1 nicht ausschlaggebend für die Regulierung der Immunantwort ist. Dieser andere Vorgang beruht auf einer chemischen Modifikation der STAT-Proteine, bei der Phosphatgruppen entfernt werden, was die Inaktivierung von STAT1 zur Folge hat. "Obwohl diese Inaktivierung tatsächlich eine weitere Produktion von Abwehrproteinen verhindert, so ist die von uns entdeckte Loslösung der STAT-Proteine von der DNA der wesentlich wirksamere und damit entscheidende Regulierungsschritt", erläutert Kovarik die Ergebnisse seines Projekts.
Strukturwandel
Obwohl es derzeit nicht bekannt ist, wie die Information des fortschreitenden Ablesens der DNA an das DNA-gebundene STAT1 übermittelt wird – und damit die Loslösung initiiert wird –, hat Kovarik eine klare Vorstellung, wie dies erfolgen könnte: "Modellberechnungen und die Ergebnisse anderer Arbeiten legen nahe, dass das Fortschreiten des Ablesens der Gene sich auf die Struktur der DNA auswirkt. Diese Strukturveränderung kann dazu führen, dass STAT1 sich von der DNA löst."
Angriffspunkt
Der nun entdeckte Mechanismus zur Regulierung von Immunantworten bietet völlig neue Möglichkeiten für therapeutische Interventionen. Denn sowohl ein zu schwach reagierendes als auch ein überreagierendes Immunsystem kann zu Problemen führen –, schwerwiegende Infektionen oder Autoimmunerkrankungen können die Folge sein. Gezielte Eingriffe in den im Rahmen dieses FWF-Projekts entdeckten Mechanismus könnten dem entgegenwirken und so die natürliche Immunantwort des Körpers optimal einsetzen. (APA)
Die Publikation "Promoter Occupancy of STAT1 in Interferon Responses Is Regulated by Processive Transcription" (AutorInnen: Ivana Wiesauer, Clemens Gaumannmüller, Iris Steinparzer, Birgit Strobl und Pavel Kovarik) erschien kürzlich im Fachmagazin Molecular and Cellular Biology.