Nebenwirkungen in Krebstherapie reduzieren
| 26. September 2014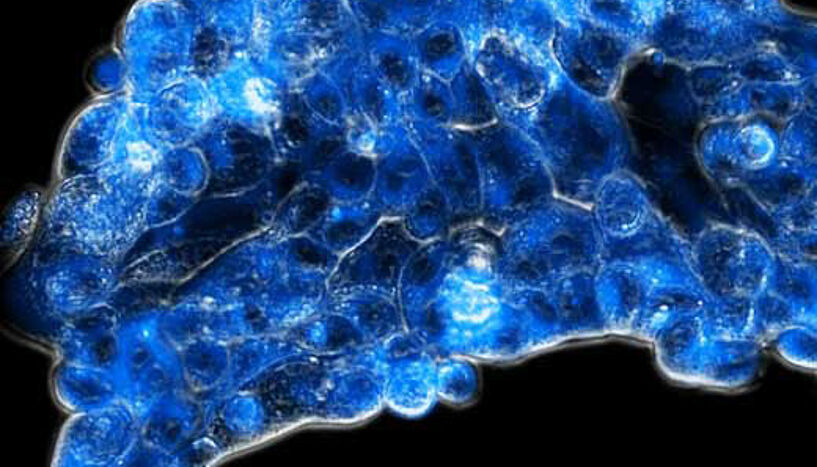
Die neue Strategie aktiviert den Wirkstoff (blau fluoreszierend) spezifisch im sauerstoffarmen Tumorgewebe (Foto: Diana Groza)
ForscherInnen der Universität Wien (Institut für Anorganische Chemie) und der Medizinischen Universität Wien (Institut für Krebsforschung) ist es gelungen, die Wirkung des Tyrosinkinase-Inhibitors auf die bösartigen Tumore zu beschränken und so Nebenwirkungen der Krebstherapie zu reduzieren.
Schwere Nebenwirkungen und Resistenzentwicklung gehören zu den größten Problemen der modernen Krebstherapie. Auch neueste zielgerichtete Krebsmedikamente, wie z.B. die Tyrosinkinase-Inhibitoren Tarceva® oder Sutent® sind von diesen Problemen betroffen. Teilweise entschließen sich die PatientInnen sogar zum Therapieabbruch.
Helfer mit Nebenwirkungen
Eine Klasse der Inhibitoren hemmt gezielt Proteine, die in Krebszellen überaktiviert sind und das krankhafte Zellwachstum antreiben. Die klinische Praxis zeigt, dass die Hemmung – bedingt durch die physiologischen Funktionen dieser Proteine im gesunden Gewebe – zu schweren Nebenwirkungen führen kann. Für diese vielversprechenden neuen Therapeutika besteht daher akuter Bedarf nach Strategien, um ihre Wirkung selektiver auf den bösartigen Tumor zu beschränken.
Gezielte Bekämpfung
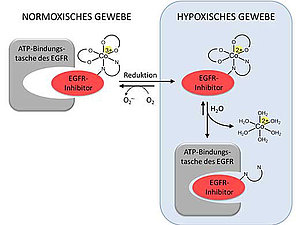
Ziel der Forschungen war die Entwicklung eines verbesserten Tyrosinkinase-Inhibitors, der nur selektiv im krankhaften Gewebe aktiviert wird. Dadurch soll die Schädigung von gesundem Gewebe verhindert und die Nebenwirkungen für die PatientInnen reduziert werden. Dem interdisziplinären Forschungsteam aus Wien gelang es nun, einen neuen Inhibitor zu synthetisieren und an Cobalt(III) zu koordinieren. Dies führt dazu, dass das Medikament vorerst seine Wirkung verliert und unter normalen physiologischen Bedingungen keine Aktivität aufweist. Nur im Tumorgewebe, wo aufgrund des schnellen Wachstums ungewöhnlich sauerstoffarme Bedingungen vorherrschen, wird die inaktive Cobalt(III)-Verbindung zu Cobalt(II) reduziert. Als Folge davon wird der aktive Wirkstoff freigesetzt. Diese tumorselektive Wirksamkeit konnte sowohl in der lebenden Zelle als auch im tumortragenden Organismus nachgewiesen werden.
Schematische Übersicht über das "Prodrug-Konzept": Inaktive Verbindung unter normoxischen Bedingungen und Aktivierung und Freisetzung des Wirkstoffs im hypoxischen Gewebe. (Foto: Claudia Karnthaler-Benbakka / Angewandte Chemie) |
Interdisziplinäre Forschungsplattform
Die komplexe Idee und Strategie gingen aus einer hervorragenden interdisziplinären Zusammenarbeit im Rahmen der Forschungsplattform "Translational Cancer Therapy Research" unter der Leitung von Bernhard Keppler, Dekan der Fakultät für Chemie der Universität Wien, und Walter Berger, Professor an der Medizinischen Universität Wien, hervor.
Diese Forschungsplattform fördert den ständigen wissenschaftlichen Austausch zwischen synthetischen ChemikerInnen der Universität Wien und KrebsforscherInnen der Medizinischen Universität Wien. Nur so ist es dem Team der UniversitätsassistentInnen Christian Kowol (Universität Wien) und Petra Heffeter (Medizinische Universität Wien) gelungen, auf der Basis zweier Diplomarbeiten (von Claudia Karnthaler-Benbakka und Diana Groza) die vorliegenden Ergebnisse zu erarbeiten.
Die Studie wurde vom Fonds der Stadt Wien für "innovative interdisziplinäre Krebsforschung", dem österreichischen Wissenschaftsfonds (FWF) und von COST CM1105 finanziell unterstützt. Die vielversprechenden Ergebnisse veranlassten die ForscherInnen, die neue Verbindungsklasse patentrechtlich schützen zu lassen. Derzeit suchen die WissenschafterInnen intensiv nach einem Partner für die weitere (klinische) Entwicklung der Inhibitoren.
Die neue Strategie gibt Hoffnung
Bisher gab es keine vergleichbare Strategie zur Reduktion der (schweren) Nebenwirkungen von Tyrosinkinase-Inhibitoren. So besteht die Hoffnung, dass in Zukunft durch den hier präsentierten Ansatz die Verträglichkeit der Therapie verbessert werden kann und auch PatientInnen von der Behandlung profitieren können, welche diese bisher abbrechen mussten. (vs)
Die Publikation "Tumor-Targeting of EGFR Inhibitors by Hypoxia-Mediated Activation" (AutorInnen: C. Karnthaler-Benbakka, D. Groza, K. Kryeziu, V. Pichler, A. Roller, W. Berger, P. Heffeter und C. R. Kowol) erschien am 30. Juli 2014 im Fachmagazin "Angewandte Chemie, International Edition".