Kryopräparation von Zellen und Geweben
| 17. Juli 2017
Helmuth Goldammer und Siegfried Reipert während des Tests eines Agitationsmoduls für die schnelle Gefriersubstitution in der Substitutionsanlage AFS2. (Foto: Universität Wien)
Um biologische Proben für die Licht- oder Elektronenmikroskopie optimal vorzubereiten, ist die sogenannte Kryopräparation eine beliebte Methode. Dabei ermöglichen spezielle Verfahren das kristallfreie Einfrieren kleiner Zell- oder Gewebeproben innerhalb weniger Millisekunden.
Durch eine derart schnelle Immobilisierung des kristallfreien Einfrierens kleiner Zell- oder Gewebeproben werden die Voraussetzungen für die Erfassung nativer biologischer Zustände erreicht. Im weiteren Präparationsverlauf gilt es, die eingefrorenen Proben bei tiefen Temperaturen mittels organischer Lösungsmittel und Fixierzusätze zu dehydrieren, chemisch zu konservieren, und sie in eine Kunstharzeinbettung zu überführen. Dieses zeitaufwendige Verfahren ist seit Jahrzehnten unter dem Namen "Gefriersubstitution" bekannt. Jüngere methodische Entwicklungen zielen darauf ab, deren Prozesszeiten deutlich zu verringern und obendrein Vorteile für den Strukturerhalt der Proben zu erzielen.
Einfriertechniken
Die Core Facility Cell Imaging und Ultrastrukturforschung ist mit einem Gerät zum Einfrieren von Proben in einem stickstoffgekühlten sekundären Kryogen – flüssiges Propan oder Ethan – ausgestattet. Dieser Plunge Freezer erzielt qualitativ hochwertige Einfrierergebnisse bis zu einer Probendicke von ca. 25 µm. Um hohe Einfrierqualität für voluminösere Proben zu erhalten, wenden wir ein Verfahren an, welches einen Jet flüssigen Stickstoffs unter Hochdruck von ca. 2000 bar auf die Probe richtet. Dieses, unter dem Begriff "Hochdruck-Kryofixierung" bekannte, Verfahren ermöglicht hohe Einfrierqualität für Probendicken bis ca. 250 µm.
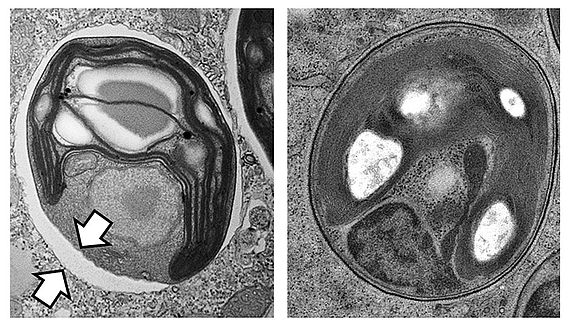
Chlorella Alge im Pantoffeltierchen
Links: Konventionelle chemische Präparation bei Raumtemperatur. Zwischen Wirtszelle und Alge klafft ein Spalt (Pfeile), welcher den Anschein vermittelt, die Alge befände sich in einer Vakuole. (Foto: Daniela Gruber) Rechts: Kryopräparation basierend auf Hochdruckkryofixierung und schneller Gefriersubstitution. Hier gibt es keinerlei Hinweis auf die Existenz derartiger Vakuolen. (Foto: Siegfried Reipert)
Fixierung durch schnelle Gefriersubstitution
Die Substitution des Zellwassers eingefrorener Proben durch Lösungsmittel (Aceton) und Fixative erfolgt bei tiefen Temperaturen in der Kryokammer einer automatischen Gefriersubstitutionsanlage. Zur Verkürzung des über Tage andauernden Substitutionsverfahrens haben wir ein Agitationsmodul entwickelt, das in die Kryokammer eingesetzt wird. Durch die Agitation der Proben reduziert sich der zeitliche Aufwand der Gefriersubstitution auf einige wenige Stunden.
Dank des Start-up Unternehmens Cryomodultech e.U. (Inh. Helmuth Goldammer), das Agitationsmodule "on demand" im 3D-Druck herstellt, findet unser patentiertes Modul gegenwärtig internationale Verbreitung - u.a. am IST Klosterneuburg, am EMBL in Heidelberg und am Kings College in London.
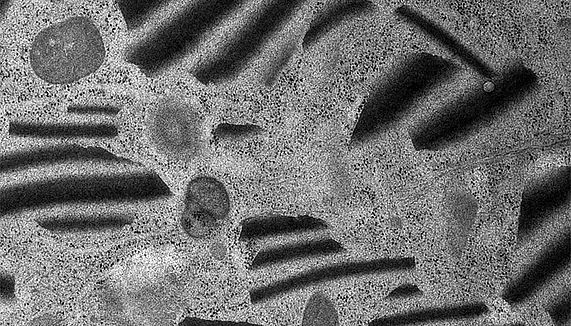
Konservierung intrazellulärer Mesostrukturen mit intrinsischen optischen Eigenschaften: Die Abbildung zeigt erstmals durch schnelle Gefriersubstitution erhaltene, zebragestreifte parakristallartige Mesostrukturen im Zytoplasma einer epidemalen Zelle. (Foto: Siegfried Reipert)
Wir setzen auf die Erschließung neuer Anwendungsbereiche der schnellen Gefriersubstitution, wie die verbesserte Konservierung intrazellulärer Kohlenhydrate, parakristalliner und mesostrukturierter Einschlüsse- bis hin zur Erfassung von Strukturen, welche bisher der Elektronenmikroskopie verborgen geblieben sind. Erste Ergebnisse belegen das Potential dieser Präparationsmethode für die Element-und Isotopenanalyse. Insbesondere die Sekundärionen-Massenspektroskopie (NanoSIMS) gewinnt durch die Korrelation analytischer Daten mit ultrastrukturellen Beobachtungen im Elektronenmikroskop an Aussagekraft.
Siegfried Reipert ist an der Core Facility für Cell Imaging und Ultrastrukturforschung tätig und Experte für Kryopräparation.