Ionenkanälen auf der Spur
| 18. Mai 2015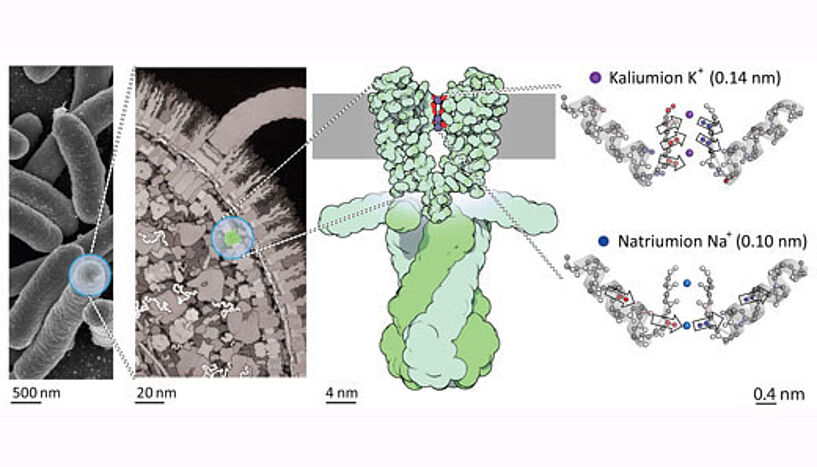
Lage des Kaliumkanals KscA in der bakteriellen Zellmembran. (Foto: David S. Goodsell & RCSB Protein Data Bank)
WissenschafterInnen um Alipasha Vaziri vom Vienna Biocenter der Universität Wien haben gemeinsam mit KollegInnen aus Chicago eine neue Methode entwickelt, um die enorme Selektivität und die Transporteigenschaften von Ionenkanälen noch besser verstehen zu können.
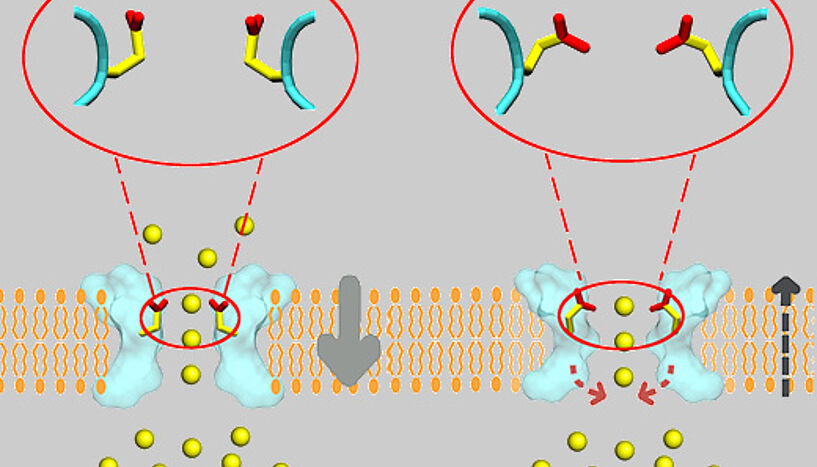
Ionenkanäle sind unverzichtbare Strukturen des Lebens. Ionenkanäle sind spezifische "Poren" in der Zellmembran, die geladene Teilchen wie Kalium- und Natriumionen in die Zelle und wieder hinaus transportieren. Dadurch kontrollieren sie eine Vielzahl von biologischen Prozessen, wie die Gehirnfunktion und den Herzschlag. Ionenkanäle sind üblicherweise nur für einzelne Ionenarten durchlässig und werden dementsprechend bezeichnet, z.B. als Kaliumkanäle und Natriumkanäle. Durch dieses spezielle Auswahlverfahren (Selektivität) kann eine Ionenart mit sehr hoher Geschwindigkeit durchströmen, während andere Ionenarten daran gehindert werden.
Kaliumkanäle sind der meistverbreitete Typ von Ionenkanälen in Zellen. Wie wichtig dieser Ionenkanaltyp ist, wurde 2003 untermauert, als Roderick MacKinnon mit dem Nobelpreis für Chemie für die Kristallstrukturaufklärung des bakteriellen KscA Kaliumkanals ausgezeichnet wurde.
Noch nicht geklärt
Trotz intensiver Forschung auf diesem Gebiet sind die exakten molekularen Mechanismen, die hinter der hohen Ionenselektivität und dem -transport der Kanäle stecken, noch nicht vollständig aufgeklärt. "Konventionelle Methoden, wie die Röntgenkristallographie, erfassen nur die starren Strukturen. Es ist daher unmöglich zu untersuchen, wie dynamisch einzelne Atome eines Proteins bei Raumtemperatur sind, also wie stark sie sich hin- und her bewegen. Doch genau die Dynamik eines Proteins ist oft der Schlüssel, um dessen präzisen Funktionsmechanismus zu verstehen", erklärt der Physiker Alipasha Vaziri, Gruppenleiter an den Max F. Perutz Laboratories (MFPL) und am Forschungsinstitut für Molekulare Pathologie (IMP) und Leiter der Forschungsplattform "Quantum Phenomena & Nanoscale Biological Systems" (QuNaBioS) der Universität Wien.
Neue Methode, um das Rätsel der Selektivität von Ionenkanälen zu lösen
Vaziris Team konnte nun gemeinsam mit Forschern am Institute for Biophysical Dynamics der University of Chicago mittels Infrarotspektroskopie in Kombination mit Computersimulationen der gewonnenen Spektren auch die kleinsten Formveränderungen des KscA Kaliumkanals untersuchen, die sich durch das Binden von Kalium oder des nur 0.04 Nanometer kleineren Natriumions ergeben. Sie entwirrten dabei die ineinander verschachtelten Infrarotspektren des Gesamtproteins, indem sie bestimmte Teile des Infrarotspektrums den entsprechenden Bausteinen des Proteins (Aminosäuren) zuordneten.
Kombination mit zweidimensionaler Infrarotspektroskopie
"Durch diesen neuen Ansatz können wir die Mechanismen ohne zeit- und kostenaufwändige Verfahren wie die sogenannte Isotopenmarkierung erforschen. Zudem ebnet dieser Zugang den Weg für die zukünftige Kombination mit zweidimensionaler Infrarotspektroskopie, was die Struktur und Dynamik von Ionenkanälen in biologisch relevanten Zeitskalen erfassen lässt", sagt Christoph Götz, PhD-Student in der Gruppe von Alipasha Vaziri und Koautor der Studie.
Dynamik in Echtzeit
Die Studie zeigt zum ersten Mal, dass die Kombination der beiden Methoden verwendet werden kann, um auch kleinste Konformationsänderungen in großen Membranproteinen, wie dem KscA Kaliumkanal, zu bestimmen. Zudem schaffen die Forscher damit die Voraussetzung, um die Dynamik von Proteinen in Echtzeit in atomarer Auflösung zu erfassen, was mit den bisher gängigen Techniken nicht möglich war. (af)
Die Publikation "Visualizing KcsA Conformational Changes upon Ion Binding by Infrared Spectroscopy and Atomistic Modeling" (AutorInnen: Paul Stevenson, Christoph Götz, Carlos R. Baiz, Jasper Akerboom, Andrei Tokmakoff and Alipasha Vaziri) erschien im April 2015 in "The Journal of Physical Chemistry B".