Die Funktionsweise unserer Muskeln
| 27. November 2014
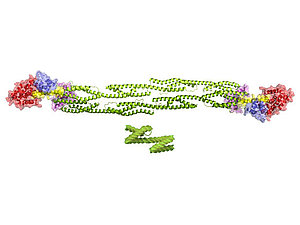
Die Illustration zeigt die Oberflächenstruktur des α-Actinin-Dimers vor dem Hintergrund einer elektronenmikroskopischen Aufnahme von Muskel-Sarkomeren. (Illustration: M. Gautel und A. Ghisleni, KCL, N. Pinotsis und K. Djinović-Carugo, MFPL)
ForscherInnen um Kristina Djinovic-Carugo von den Max F. Perutz Laboratories (MFPL) der Universität Wien und der Medizinischen Universität Wien haben die molekulare Funktionsweise des Muskelproteins a-Actinin aufgeklärt. Die neuen, Erkenntnisse könnten zur besseren Behandlung von Muskelerkrankungen beitragen.
Um Bewegungen jeglicher Art ausführen zu können, sind die meisten Tiere auf Muskeln angewiesen. Sei es um zu essen, sich zu verteidigen oder zu fliehen. Die kleinste funktionelle Einheit eines Muskels ist das Sarkomer, von denen Hunderte hintereinander angeordnet sind und so eine Muskelfaser bilden.
"Sarkomere bestehen zum größten Teil aus Proteinsträngen, sogenannten Filamenten, von Actin und Myosin. Damit ein Muskel sich verkürzen – also kontrahieren – kann, müssen sich diese Filamente gegeneinander verschieben können und in festen Ebenen, den Z-Scheiben, verankert sein. Z-Scheiben bestehen zum Großteil aus dem Protein α-Actinin, welches auch das Protein Titin verankert. Titin ist dafür verantwortlich, dass die Actin- und Myosinfilamente eines Sarkomers korrekt angeordnet sind, und stellt nach getaner Muskelarbeit die ursprüngliche Länge des Sarkomers wieder her", erklärt Strukturbiologin Kristina Djinović-Carugo.
Wichtige Rolle in Herz- und Muskelerkrankungen
α-Actinin ist ein lebenswichtiges Protein – Embryonen, die es nicht herstellen können, sterben. Wird α-Actinin zwar gebildet, funktioniert es aber nicht richtig, sind Muskelerkrankungen wie Muskeldystrophien und Kardiomyopathien die Folge. Mit dem Wissen über die genaue Struktur und Funktionsweise von α-Actinin und Muskeln ließe sich nicht nur die Rolle von fehlerhaften, also mutierten α-Actinin-Formen in Erkrankungen besser verstehen, sondern auch die Diagnose erleichtern. Schlussendlich könnte das die Entwicklung neuer Behandlungsmöglichkeiten unterstützen.
Detailstruktur des α-Actinin Dimers. Der Kopf ist rot hervorgehoben, die Halsregion ist gelb eingefärbt, und die L-förmigen Domänen sind in lila und blau dargestellt. Die blaue Domäne wechselwirkt mit der Titin-ähnlichen Domäne der Halsregion des entgegengesetzt liegenden α-Actinin Moleküls. Der stabförmige Körper besteht aus helikalen Strukturen (grün), die zick-zack-förmig angeordneten Fusilli-Nudeln ähneln. (Illustration: Kristina Djinović-Carugo, MFPL) |
|---|
Per Röntgenkristallographie die Struktur erkennen
Die Struktur von Muskelproteinen ist eines der Forschungsthemen von Kristina Djinović-Carugo an den Max F. Perutz Laboratories (MFPL) der Universität Wien und dem Department für Struktur- und Computerbiologie. Die Leiterin des "Laura Bassi Centre of Optimized Structural Studies" erklärt: "Mithilfe einer Technik namens Röntgenkristallographie haben wir die Struktur von α-Actinin aufgeklärt. Wir haben Jahre gebraucht, um genügend große Mengen hochwertigen Proteins zu produzieren und geeignete Kristalle für unsere Analysen herzustellen."
Mit Geduld und innovativen Ansätzen gelang es den ForscherInnen schließlich, die Struktur von α-Actinin in hoher Auflösung aufzuklären und in enger Zusammenarbeit mit Mathias Gautel vom "British Heart Foundation Centre of Research Excellenz" am KCL auch zu zeigen, wie das Protein reguliert wird.
Struktur ähnelt Fusilli-Nudeln
Die Strukturaufklärung zeigte, dass α-Actinin einen symmetrischen Komplex bestehend aus zwei Molekülen bildet. Jedes dieser Moleküle hat einen Kopf, Hals und stabförmigen Körper, der vier zick-zack-artig angeordneten Fusilli-Nudeln ähnelt. Der Kopf von α-Actinin bindet Actin, während zwei L-förmige Domänen am Ende des Körpers mit der Halsregion des anderen Moleküls wechselwirken. Die Ergebnisse zeigten auch, dass die Gesamtstruktur mehr ist als nur die Summe ihrer Teile: Die genau entgegengesetzte Anordnung zweier α-Actinin-Moleküle erlaubt nicht nur die gleichzeitige Wechselwirkung mit Actin und Titin und deren Verankerung in der Z-Scheibe, sondern ermöglicht auch diese Wechselwirkung zu regulieren.
Fettsäure PIP2 steuert die α-Actinin-Funktion
"Es gab schon seit einigen Jahren die Hypothese, dass die Wechselwirkung zwischen α-Actinin und Titin durch ein Fettsäuremolekül namens PIP2 ein- und ausgeschalten wird. Unsere Strukturdaten haben nun zum ersten Mal gezeigt, wie die Fettsäure das α-Actinin-Muskelprotein öffnet und schließt und so seine Fähigkeit, Actin und Titin zu binden, steuert", erläutert Kristina Djinović-Carugo. Ist kein PIP2-Molekül gebunden, wechselwirkt eine der beiden L-förmigen α-Actinin-Domänen mit dem Hals des entgegengesetzt liegenden Moleküls, welcher strukturell Titin stark ähnelt. Ist PIP2 vorhanden, löst sich die L-förmige Domäne vom Hals und wechselwirkt stattdessen mit Titin.
Die Dynamik von α-Actinin und seiner Wechselwirkung mit PIP2 klärte das Team in Zusammenarbeit mit Katharina Pirker (Universität für Bodenkultur Wien) und Bojan Žagrović (MFPL) auf. Die ForscherInnen um Mathias Gautel veränderten α-Actinin zudem so, dass es kein PIP2 mehr binden konnte oder so blockiert war, dass die Wechselwirkung mit Titin nicht mehr gelöst werden kann. Die Ergebnisse zeigten, dass sich in beiden Fällen keine geordneten Sarkomere mehr bilden konnten; so ein Muskel wäre funktionsunfähig.
Langfristige Förderung und internationale Zusammenarbeit als Grundlage
"Unsere Ergebnisse liefern neue Einblicke in den molekularen Aufbau und Funktionsweise eines Muskels. Das wird helfen Muskelerkrankungen besser zu verstehen und Behandlungsmöglichkeiten für diese zu entwickeln", so Kristina Djinović-Carugo und fügt hinzu: "Ohne eine langfristige Förderung durch den FWF, die Universität Wien, die FFG, das EU-FP7 Marie Curie Action 'Networks for iNitial Training'-Programm, die British Heart Foundation sowie die langjährige intensive Zusammenarbeit mit Mathias Gautel und Katarina Pirker wäre dieses Projekt nicht möglich gewesen. Diese Veröffentlichung beruht auf acht Jahren harter Arbeit."
Die Publikation "The structure and regulation of human muscle α-actinin" (AutorInnen: Euripedes de Almeida Ribeiro, Nikos Pinotsis, Kristina Djinović-Carugo et al.) erschien im Dezember 2014 in "Cell".