Wiener ForscherInnen entdecken neue Stressreaktion in Bakterien
27. September 2011Bakterien reagieren ständig auf Veränderungen ihrer Lebensbedingungen. Insbesondere jene, die andere Lebewesen infizieren, sind der Reaktion des Immunsystems ihres Wirts – Temperaturschwankungen, unterschiedliche pH-Werte, Antibiotika oder Nährstoffmangel – ausgesetzt. Das verursacht starken Stress. Um diese "unwirtlichen" Bedingungen zu überleben, haben Bakterien entsprechende Anpassungsstrategien entwickelt. Molekularbiologin Isabella Moll und ihr Team von den Max F. Perutz Laboratories der Universität Wien haben nun einen neuen Mechanismus zum Überleben entdeckt. Dieser beruht nicht auf dem Ein- bzw. Ausschalten von Genen, sondern auf der gezielten Veränderung der Ribosomen, der "Proteinfabriken" in der Zelle. Die Ergebnisse erscheinen im renommierten Fachmagazin "Cell".
Die meisten Stressreaktionen basieren auf Veränderung der Transkription, also darauf, dass bestimmte Gene ein- bzw. ausgeschaltet werden. Bei der Transkription werden die aktiven Gene abgelesen, und es entsteht eine Vorlage für die Herstellung von Proteinen – die sogenannte mRNA (messenger RNA). Nach dieser Vorlage werden dann von den Ribosomen Proteine zusammengesetzt – die sogenannte Translation, die der Transkription nachgelagert ist. "Die Strategie, die wir entdeckt haben, setzt bei der Translation an und erlaubt den Bakterien eine Art 'Feinjustierung' ihrer Stressantwort", erklärt Isabella Moll, Gruppenleiterin an den Max F. Perutz Laboratories der Universität Wien und Hauptautorin der Studie.
Zelltod als Überlebensstrategie
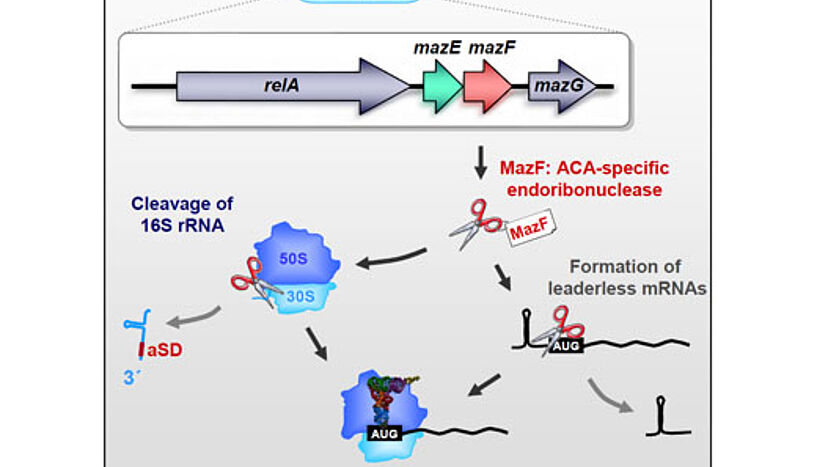
Die ForscherInnen haben dazu einen bereits bekannten Mechanismus – das sogenannte Toxin/Antitoxin-System MazEF – am Bakterium "Escherichia coli" genauer unter die Lupe genommen. Es besteht aus zwei hintereinander liegenden Gensequenzen, die jeweils für ein Gift und ein Gegengift – in diesem Fall MazF und MazE – codieren. Unter normalen Bedingungen halten die beiden ein Gleichgewicht. Steht die Zelle unter Stress, gerät das chemisch instabilere Gegengift MazE ins Hintertreffen, und MazF entfaltet seine toxische Wirkung. Es baut den Großteil der mRNA-Moleküle – also der Produktionsvorlagen – ab, wodurch die Proteinproduktion der Zelle unterdrückt wird.
Das wirkt auf den ersten Blick absurd, löst aber einen durchaus sinnvollen, höchst interessanten Prozess aus: Unter ungünstigen Umweltbedingungen, etwa durch Antibiotika oder Nahrungsmangel, begeht ein Teil der Bakterien auf diese Weise sozusagen "altruistischen Selbstmord". MolekularbiologInnen sprechen vom programmierten Zelltod, durch den einzelne Zellen sich selbst töten. Dadurch stehen den anderen, überlebenden Zellen wieder vermehrt Nährstoffe zur Verfügung, was insgesamt zum Überleben der Population beiträgt.
Überraschende Doppelfunktion
"Wir haben aber beobachtet, dass nicht die gesamte Proteinproduktion betroffen war. Ein kleiner Teil der Proteine wurde trotzdem erzeugt", erzählt Isabella Moll. "Da wollten wir natürlich wissen, warum das so ist, und wie das auf molekularer Ebene funktioniert". Die WissenschafterInnen untersuchten, wie MazF die mRNAs zerstört und konnten zeigen, dass bei bestimmten mRNAs die spezifische "Erkennungssequenz" am Anfang abgeschnitten wird. Die dadurch entstehenden "leaderless" mRNAs werden von den Ribosomen nicht mehr als Proteinvorlage erkannt. Gleichzeitig entdeckten die ForscherInnen aber auch, dass MazF auch einen Teil der Ribosomen verändert: Das Toxin schneidet einen funktionell wichtigen Teil der ribosomalen RNA ab, wodurch die Spezifität der Ribosomen verändert wird. Diese speziellen "Stress-Ribosomen" erlauben dann nur noch die gezielte Translation der "leaderless" mRNAs und produzieren daher nur noch jene Proteine, die zur Stressantwort gebraucht werden. "MazF hat also keine ausschließlich destruktive Funktion, wie bisher angenommen, sondern spielt vielmehr eine regulierende Rolle bei der Stressreaktion", so Molekularbiologin Isabella Moll.
Die Ergebnisse der in der Fachzeitschrift "Cell" veröffentlichten Arbeit könnten dazu beitragen, dass potentielle Angriffspunkte identifiziert und in weiterer Folge neue Medikamente gegen krankheitserregende Bakterien entwickelt werden.
Publikation
Oliver Vesper, Shahar Amitai, Maria Belitsky, Konstantin Byrgazov, Anna Chao Kaberdina, Hanna Engelberg-Kulka and Isabella Moll. Selective Translation of Leaderless mRNAs by Specialized Ribosomes Generated by MazF in Escherichia coli. In: Cell (2011), doi:10.1016/j.cell.2011.07.047
Die Max F. Perutz Laboratories (MFPL) sind ein gemeinsames Forschungs- und Ausbildungszentrum der Universität Wien und der Medizinischen Universität Wien am Campus Vienna Biocenter. An den MFPL sind rund 450 WissenschafterInnen in über 60 Forschungsgruppen mit Grundlagenforschung im Bereich der Molekularbiologie beschäftigt.
Wissenschaftlicher Kontakt
Dr. Isabella Moll
Max F. Perutz Laboratories
Universität Wien
1030 Wien, Dr.-Bohr-Gasse 9
T +43-1-4277-546 06
isabella.moll(at)univie.ac.at
Rückfragehinweis
Gabriele Schaller
Max F. Perutz Laboratories
Communications
1030 Wien, Dr.-Bohr-Gasse 9
T +43 1 4277-240 14
communications(at)mfpl.ac.at
Wissenschaftlicher Kontakt
Dr. Isabella Moll
Max. F. Perutz LaboratoriesUniversität Wien
1030 - Wien, Dr.-Bohr-Gasse 9
+43-1-4277-546 06
isabella.moll@univie.ac.at