Erstmals Ionenfluss "filmisch" festgehalten
01. September 2014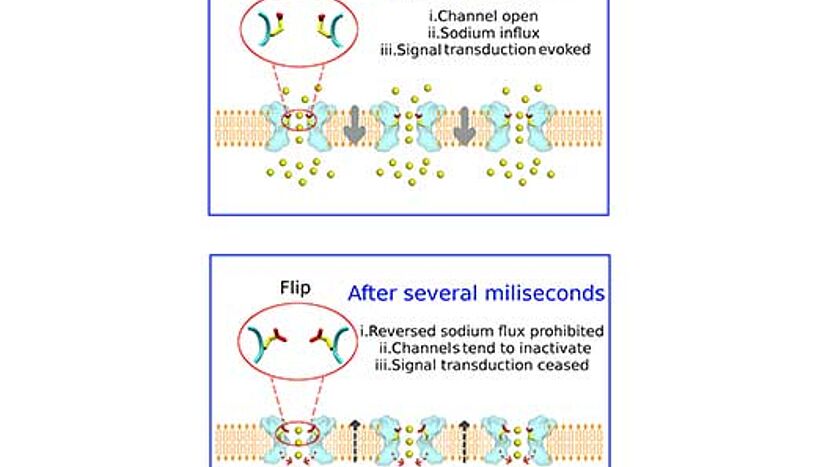
Schematische Darstellung des Natriumionenkanals (hellblau). Oben: Einstrom von Natriumionen (gelb gefärbt) und Orientierung der Aminosäure E53 in der "nicht geflippten Orientierung". Unten: Konformationsänderung von E53 ("Flip-Stellung") während des Ionenausstroms, Pfeile symbolisieren die "Barriere" für den Ionenausstrom. (Copyright: Song Ke)
Utl.: Vienna Scientific Cluster ermöglicht neue High-Tech-Computersimulation
Ionenkanäle sind für eine Vielzahl physiologischer und pathophysiologischer Prozesse im menschlichen Körper lebenswichtig. Ein junges Forschungsteam unter der Leitung von Anna Stary-Weinzinger, Pharmakologin an der Universität Wien, erforschte den Mechanismus des Ionenflusses durch spannungsgesteuerte Natriumionenkanäle. Da dieser Prozess mit einer unglaublichen Geschwindigkeit abläuft – es fließen bis zu 100 Millionen Ionen pro Sekunde –, wurden Computersimulationen durchgeführt, um den Natriumfluss sozusagen in Zeitlupe zu beobachten. Ermöglicht wurde dies durch die Rechenleistung des Vienna Scientific Cluster (VSC), dem schnellsten Computer Österreichs. Die Erkenntnisse sind aktuell in der renommierten Fachzeitschrift PLOS Computational Biology erschienen.
Spannungsgesteuerte Ionenkanäle generieren lebensnotwendige elektrische Signale im menschlichen Körper. Ohne diese Proteine könnten zentrale Funktionen wie z.B. unser Herzschlag, die Signalweiterleitung im Gehirn oder Muskelbewegungen nicht stattfinden. Besonders faszinierend ist, dass diese Proteine "wählerisch" sind: Sie lassen selektiv nur bestimmte Ionen durch und ermöglichen dabei trotzdem enorme Durchflussraten.
Mehr über die Funktionsweise der außergewöhnlichen Ionenkanäle verrät der Blick auf ihre Kristallstrukturen: Diese zeigen unter anderem eine kurze, mit Wasser gefüllte "Filterstruktur", die von vier negativ geladenen Aminosäuren umgeben ist. Sie ist für den selektiven Natriumfluss verantwortlich. Da Kristallstrukturen jedoch "statische" Momentaufnahmen darstellen, ist es sehr schwierig, daraus Rückschlüsse auf jene dynamischen Prozesse zu ziehen, die den Ionenfluss erst ermöglicht. Diese Fragestellungen eignen sich optimal für Computersimulationen.
Simulationen des schnellsten Computers Österreichs "filmen" Ionenbewegungen
Um den faszinierenden Proteinen quasi bei der Arbeit zusehen zu können, hat das Team vom Department für Pharmakologie und Toxikologie der Universität Wien sogenannte Moleküldynamiksimulationen durchgeführt. Die für diese Analyse notwendige Rechenleistung lieferte der Vienna Scientific Cluster (VSC), der schnellste Computer Österreichs. Dabei entdeckten die ForscherInnen der Universität Wien, dass der Ionenfluss vom Extrazellularraum in die Zelle deutlich schneller erfolgt als in die umgekehrte Richtung. "Den Schlüssel für diese überraschende Entdeckung liefert eine negativ geladene Aminosäure: Glutaminsäure 53, kurz E53", erklärt Pharmakologin Anna Stary-Weinzinger, Leiterin des Forschungsprojekts an der Universität Wien: "E53 kann je nach Ionenflussrichtung ihre Konformation verändern und moduliert dadurch die Ionenflussgeschwindigkeit."
Glutaminsäure E53 reguliert den Ionenfluss
Die Moleküldynamiksimulationen zeigen, dass die Aminosäure E53 zwei unterschiedliche Orientierungen einnehmen kann, je nach Richtung des Ionenflusses. Durch diese "Schaltungsfunktion" ermöglicht E53 einen schnellen Ioneneinstrom in die Zelle, wenn es sich in der sogenannten "nicht geflippten Auswärtsstellung" befindet. In der "Flip-Stellung" hingegen beschleunigt E53 das Ausströmen der Ionen: "Mit Hilfe 'Freier Energie Berechnungen' konnten wir zeigen, dass der Weg aus der Zelle für die Ionen schwieriger ist als jener in die Zelle, weil es im Protein eine sogenannte 'Energiebarriere' für den auswärts gerichteten Natriumfluss gibt", erklärt Song Ke, Dissertant in der Gruppe von Anna Stary-Weinzinger an der Universität Wien, genauer: "In der 'Flip'-Stellung hilft E53 den Ionen dabei, diese Hürde zu überwinden."
Die ForscherInnen halten es für wahrscheinlich, dass diese Bewegungen auch eine wichtige Rolle bei der sogenannten "Inaktivierung" spielen – jenem Mechanismus, der den Ionenfluss kontrolliert stoppt, um die Signalweiterleitung zu unterbrechen.
Gefördert wurde diese Arbeit vom FWF-Doktoratskolleg "Molecular Drug Targets" (MolTag), das von Steffen Hering, Vorstand des Departments für Pharmakologie und Toxikologie der Fakultät für Lebenswissenschaften der Universität Wien, geleitet wird.
Publikation in PLOS Computational Biology:
Different Inward and Outward Conduction Mechanisms in NaVMs Suggested by Molecular Dynamics Simulations: Song Ke, E. N. Timin, Anna Stary-Weinzinger. PLOS Computational Biology, July 2014.
DOI: 10.1371/journal.pcbi.1003746
Wissenschaftlicher Kontakt
Mag. Dr. Anna Stary-Weinzinger
Department für Pharmakologie und Toxikologie
Universität Wien
1090 Wien, Althanstraße 14 (UZA II)
T +43-1-4277-553 11
anna.stary(at)univie.ac.at
Rückfragehinweis
Mag. Veronika Schallhart
Pressebüro der Universität Wien
Forschung und Lehre
Universität Wien
1010 Wien, Universitätsring 1
T +43-1-4277-175 30
M +43-664-602 77-175 30
veronika.schallhart(at)univie.ac.at
Wissenschaftlicher Kontakt
Ass.-Prof. Mag. Dr. Anna Weinzinger, Privatdoz.
Department für Pharmakologie und ToxikologieUniversität Wien
1090 - Wien, Josef-Holaubek-Platz 2
+43-1-4277-553 11
anna.stary@univie.ac.at
Rückfragehinweis
Mag. Veronika Schallhart
DLE ÖffentlichkeitsarbeitUniversität Wien
1010 - Wien, Universitätsring 1
+43-1-4277-17530
+43-664-8176793
veronika.schallhart@univie.ac.at
Downloads:
Ion-flux_Keetal__c__Song_Ke.jpg
Dateigröße: 1,86 MB
