Die Entdeckung der Cyanatfresser
29. Juli 2015Neue Erkenntnisse zu Verbreitung und Aktivität von Mikroorganismen
Die Aktivität Ammoniak- und Nitrit-oxidierender Mikroben ist für den globalen Stickstoffkreislauf und damit für das Leben auf unserer Erde von wesentlicher Bedeutung. In einer im Fachmagazin "Nature" erschienenen Arbeit berichten ForscherInnen um Michael Wagner vom Department für Mikrobiologie und Ökosystemforschung der Universität Wien, dass diese Mikroben als erste bekannte Lebewesen überhaupt auch ausschließlich von Cyanat als Energiequelle leben können und manche sich dazu sogar gegenseitig füttern. Somit wurden ein neuer Umweltfaktor und ein neues Interaktionsmuster entdeckt, welche für die Verbreitung und Aktivität dieser Mikroorganismen eine wichtige Rolle spielen könnten.
Der globale Stickstoffkreislauf ist von zentraler Bedeutung für alles Leben auf der Erde und wird vor allem durch vielfältige Stoffwechselleistungen von Mikroorganismen (Bakterien und Archaeen) am Laufen gehalten. Um die wachsende Weltbevölkerung ernähren zu können werden in der industriellen Landwirtschaft enorme Mengen der Stickstoffverbindungen Ammonium und Harnstoff als Dünger eingesetzt, von denen aber nur ein Bruchteil von den Pflanzen aufgenommen wird. Der Rest gelangt ins Grundwasser, in Seen, Flüsse und die Ozeane und führt dort zu massiven Problemen bis hin zur Ausbildung von Todeszonen. Somit greift der Mensch in den Stickstoffkreislauf auf ähnlich dramatische Weise wie in den Kohlenstoffkreislauf ein. Um die Folgen des Einflusses des Menschen auf den ökologisch wichtigen Stickstoffkreislauf besser vorhersagen zu können, ist es zwingend notwendig, die daran beteiligten Mikroben und vor allem deren Stoffwechseleigenschaften genauer verstehen zu lernen.
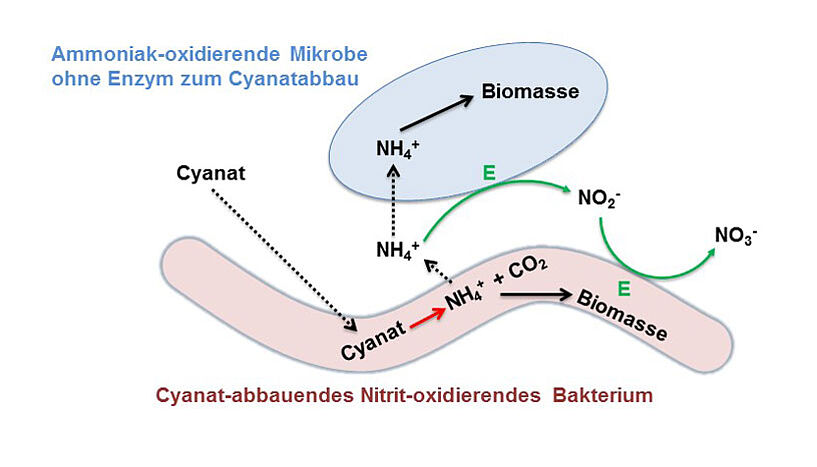
Ammoniak- und Nitrit-oxidierende Mikroben spielen bei der Umwandlung von Stickstoffverbindungen in der Umwelt eine zentrale Rolle. Trotz der inzwischen bekannten Vielfalt dieser Lebewesen gingen Mikrobiologen bisher davon aus, dass Ammoniak-oxidierende Mikroben ausschließlich in Anwesenheit von Ammonium bzw. Harnstoff als Energiequelle wachsen können. Umso überraschender ist der heute von Michael Wagner und seinem Team veröffentlichte Befund, dass das Ammoniak-oxidierende Archaeon Nitrososphaera gargensis mit Cyanat als einziger Energiequelle wachsen kann. "Wir haben es in jahrelanger Arbeit geschafft, diesen Organismus als Reinkultur im Labor zu züchten. Durch dessen Genomsequenzierung haben wir erste Hinweise erhalten, dass es mittels eines speziellen Enzyms Cyanat verwenden könnte, indem es dieses in Ammonium und Kohlendioxid umwandelt. Durch aufwändige physiologische Studien ist es uns nun gelungen, dies experimentell nachzuweisen", erläutert Marton Palatinszky, Erstautor der Studie.
Auf den ersten Blick überraschend war die Tatsache, dass viele andere Ammoniak-oxidierende Mikroben das für die Cyanatverwertung notwendige Enzym nicht besitzen, während alle bekannten Nitrit-Oxidierer dieses Enzym produzieren. Wagner und KollegInnen konnten zeigen, dass diesem unerwarteten Verteilungsmuster eine neuartige Interaktion zwischen Ammoniak- und Nitrit-oxidierenden Mikroben zugrunde liegt. Normalerweise füttern die Ammoniak-oxidierenden Mikroben die Nitrit-oxidierenden Bakterien, indem sie Ammoniak zu Nitrit umwandeln, welches dann von den Nitrit-Oxidierern zu Nitrat umgesetzt wird. Die Nitrit-Oxidierer sind also von den Ammoniak-Oxidierern abhängig. Im Fall von Cyanat ist das anders: Die Nitrit-Oxidierer nehmen Cyanat aus der Umwelt auf und wandeln dieses in Ammonium um, das sie ausscheiden. Mit den Nitrit-Oxidierern zusammen lebende Ammoniak-Oxidierer können dann Ammonium in Nitrit umwandeln und dadurch wachsen. Das von ihnen ausgeschiedene Nitrit dient dann wiederum den Nitrit-Oxidierern als Energiequelle. "So können also Ammoniak- und Nitrit-oxidierende Mikroben durch wechselseitiges Füttern gemeinsam auf Cyanat wachsen, auch wenn nur die Nitrit-oxidierenden Mikroben die genetische Ausstattung zur Cyanatverwertung besitzen", erklärt Holger Daims, Co-Autor der Studie. Im Gegensatz zu ihrer seit über hundert Jahren bekannten "normalen" Interaktion vollzieht hier also der Nitrit-Oxidierer den ersten Schritt.
Cyanat ist ein aus drei Atomen (Sauerstoff, Stickstoff und Kohlenstoff) bestehendes kleines Molekül, das in der Umwelt aus Harnstoff und durch den Abbau von Blausäure, die viele Pflanzen als Fraßschutz bilden, entsteht. Erst seit zwei Jahren steht eine Methode zur Verfügung, um Cyanat in den in der Umwelt relevanten niedrigen Konzentrationen nachzuweisen. Bislang wurden mit dieser Methode aber nur wenige Meerwasserproben untersucht, in denen prompt Cyanat gefunden wurde. "Die genetische Grundausstattung zum Cyanatabbau durch Mikroben des Stickstoffkreislaufs ist in vielen Umweltproben vorhanden. Wir bestimmen nun die Cyanatkonzentrationen und Umsatzraten in Böden, Süß- und Meerwasserproben, um die quantitative Bedeutung der Cyanatfresser für den globalen Stickstoffkreislauf abschätzen zu können. Inzwischen haben wir erste Hinweise, dass auch die in den Sauerstoff-Minimum-Zonen der Meere eine wichtige Rolle spielenden anaeroben Ammonium-Oxidierer (Anammox) Cyanat verwenden können, so dass die Verbreitung und Bedeutung der Cyanatfresser sogar noch größer als in unserer Veröffentlichung angenommen sein könnte", so Wagner abschließend.
Weitere Informationen:
http://www.microbial-ecology.net
http://dmes.univie.ac.at
Publikation in "Nature":
Marton Palatinszky, Craig Herbold, Nico Jehmlich, Mario Pogoda, Ping Han, Martin von Bergen, Ilias Lagkouvardos, Søren M. Karst, Alexander Galushko, Hanna Koch, David Berry, Holger Daims und Michael Wagner: Cyanate as energy source for nitrifiers, in: Nature, 12 June 2015,
DOI: 10.1038/nature14856
Wissenschaftlicher Kontakt
Univ.-Prof. Mag. Dr. Michael Wagner
Zentrum für Mikrobiologie und UmweltsystemwissenschaftUniversität Wien
1030 - Wien, Djerassiplatz 1
+43-1-4277-912 00
+43-664-602 77-912 00
michael.wagner@univie.ac.at
Rückfragehinweis
Mag. Alexandra Frey
Media Relations ManagerUniversität Wien
1010 - Wien, Universitätsring 1
+43-1-4277-17533
+43-664-8175675
alexandra.frey@univie.ac.at